السيريوم Cerium – الخواص الفيزيائية والكيميائية للسيريوم
محتويات الموضوع
ما هو عنصر السيريوم Cerium؟
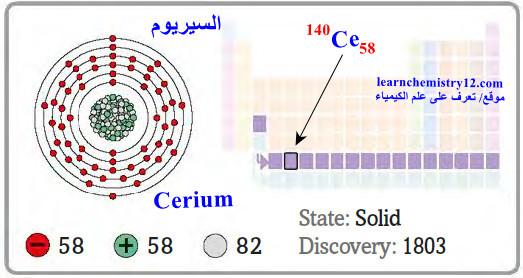
– السيريوم Cerium هو عنصر من عناصر الجدول الدوري: العدد الذري = 58 ، العدد الكتلي = 140
– الرمز الكيميائي لعنصر السيريوم يرمز له بالرمز: 140Ce58
– التوزيع الإلكتروني له: Xe]54 6s2 4f1 5d1]
– يعد السيريوم من العناصر النادرة.
– وهو فلز ذو لون أبيض فضي حيث يتلاشى الشكل النقي للمعدن عند ملامسته للهواء حيث تتحول الطبقة الخارجية للون الأسود.
– ينتمي إلى فصيلة اللانثانيدات.
– كان السيريوم أول اللانثانيدات التي تم اكتشافها.
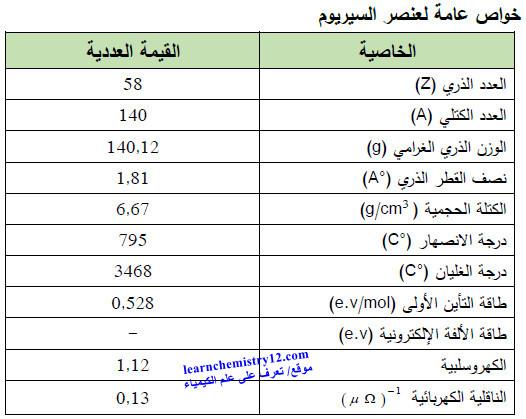
– الجدول التالي يوضح الخواص العامة لعنصر السيريوم كما يلي:
اكتشافه ووجوده في الطبيعة Discovery of Cerium
– اكتشف من قبل (كلابيروت)، (برزيلوس) و (هايزنبرغ) في السويد سنة 1804م.
– اشتق اسمه من الكلمة اللاتينية (سيريس Ceres) وهو اسم نيزك اكتشف عام 1801م وذلك للتقارب في سنوات الاكتشاف.
– يوجد مبعثراً في الطبيعة خاصة على شكل أكاسيد ومترافقاً مع عناصر أخرى من مجموعته.
– علاوة على ذلك تبلغ وفرته في القشرة الأرضية ما يقارب 0.004 وزناً.
تحضير السيريوم Preparation of Cerium
– تلخص طريقة تحضير السيريوم في خطوات ثلاث كما يلي:
- يسخن السيريوم الخام بحمض الكبريتيك المركز.
- يضاف إليه الماء لجعل تركيز الحمض 50%
- يجمع السيريوم المترسب ويبرد بالماء.
مركبات السيريوم Cerium Compound
(1) ثاني أكسيد السيريوم CeO2
– يحضر أكسيد السيريوم عديم اللون في حالته النقية بتسخين السيريوم أو هيدروكسيده أو أحد أملاحها (مثل النترات أو الكربونات) في الهواء.
– يتميز بخمول كيميائي فهو لا ينحل في الأحماض أو الأسس القوية.
– علاوة على ذلك فأنه يذوب في الأحماض بوجود عامل اختزال مثل (+Sn2) مشكلاً +Ce3 الذي يتحول بفعل عامل مؤكسد قوي إلى الأيون +Ce4 الذي يستعمل في الكيمياء التحليلية كمؤكسد قوي في وسط حمضي.
(2) هيدروكسيد السيريوم Ce(OH)4
– يمكن لبعض عناصر اللانثانيدات أن تأخذ بالإضافة إلى درجة أكسدة (+3)، درجتي (+4) ، (+2).
– السيريوم هو العنصر الوحيد في فصيلة اللانثانيدات الذي يوجد في المحاليل المائية أو المركبات الصلبة بدرجة أكسدة (+4).
– يتكون الهيدروكسيد Ce(OH)4 على شكل راسب غروي أصفر بإضافة أيونات –OH إلى محاليل +Ce4
– يتشكل Ce(OH)4 بسهولة بأكسدة Ce(OH)3 بأكسجين الهواء كما بالتفاعل التالي:
4Ce(OH)3 + O2 + 2H2O → 4Ce(OH)4
– المركب Ce(OH)4 ينحل في الأحماض مشكلاً محاليل برتقالية اللون، تنتج من تشكل بلورات هيدراتية (بلورات مميهة) مثل: Ce(SO4)2.4H2O
(3) أملاح السيريوم
– تتحلل أملاح السيريوم في الماء بشدة.
– يتميز بعضها بعدم الثبات، ولكن النواتج الثابتة لحد ما هي الأملاح المضاعفة:
- أصفر Na2[Ce(NO3)6]
- أحمر K2[Ce(NO3)6]
- أحمر Ca[Ce(NO3)6].8H2O
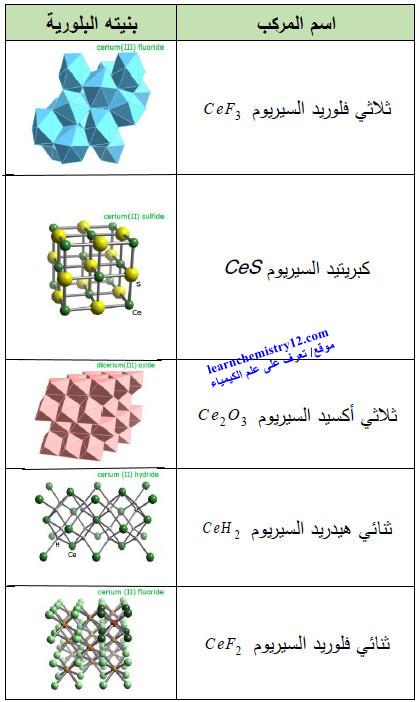
(4) مركبات أخري
– الجدول التالي يوضح أهم مركبات السيريوم الأخرى المشهور كما يلي:
الخواص الكيميائية لعنصر السيريوم Chemical properties of Cerium
(1) التفاعل مع الهواء
– السيريوم المعدني يتشوه ببطء في الهواء ويحترق بسهولة لتشكيل ثنائي أكسيد السيريوم ذو الصيغة CeO2 كما بالتفاعل التالي:
Ce + O2 → CeO2
(2) التفاعل مع الماء
– معدن السيريوم يتميز بكهرو إيجابية عالية فيتفاعل ببطء مع الماء البارد وبسرعة مع الماء الساخن لتشكيل هيدروكسيد السيريـوم وانطلاق غاز الهيدروجين كما بالتفاعل التالي:
2Ce(s) + 6H2O(g) → 2Ce(OH)3(aq) + 3H2(g)
(3) التفاعل مع الهالوجينات
– علاوة على ذلك السيريوم يتفاعل مع كل الهالوجينات لتشكيل هاليدات السيريـوم الثلاثية.
– ومنه يتفاعل مع الفلور والكلور والبروم واليود ليشكل على التوالي ثلاثي فلوريد السيريـوم، ثلاثي كلوريد السيريـوم، ثلاثي بروميد السيريـوم وثلاثي يوديد السيـريوم، كما بالتفاعلات التالية:
أبيض 2Ce(s) + 3F2(g) → 2CeF3(s)
أبيض 2Ce(s) + 3Cl2(g) → 2CeCl3(s)
– أما فى حالة البروم واليود فيكون كما بالمعادلات الآتية:
أبيض 2Ce(s) + 3Br2(g) → 2CeBr3(s)
أصفر 2Ce(s) + 3I2(g) → 2CeI3(s)
(4) التفاعل مع الأحماض
– معدن السيريوم يذوب بسهولة في حمض الكبريتيك المخفف لتشكيل محلول عديم اللون يحتوي على أيون السيريـوم الثلاثي وفق التفاعل التالي:
2Ce(s) + 3H2SO4(aq) → 2Ce3+(aq) + 3SO4-2 (aq) + 3H2(g)
استخدامات السيريوم Uses of Cerium
(1) يستعمل السيريوم في مصابيح الغاز ويستخدم في الصناعة بكثرة، ويعطي مع الألمنيوم، المغنسيوم والنيكل سبائك مقاومة للحرارة مفيدة جداً لصنع الطائرات والصواريخ.
(2) مزيل مثالي للغاز، ويحسن الفولاذ، لأنه يزيل جيوب الغاز التي تتألف داخله، وتكون كالشعر والشقوق داخل المعدن، ويستثمر العلماء خواص المعدن هذه بجعله يمتص الجزيئات القليلة التي تبقى داخل المعدن، ويستثمر العلماء خواص المعدن هذه بجعله يمتص الجزيئات القليلة التي تبقى داخل جوف يراد أن يحدث فيه أحسن خلاء ممكن.
(3) يستعمل في المعالجة الطبية بشكل مركب عضوي فأحماض السيريـوم هي معقمة.
(4) يستعمل في الصناعة الذرية.
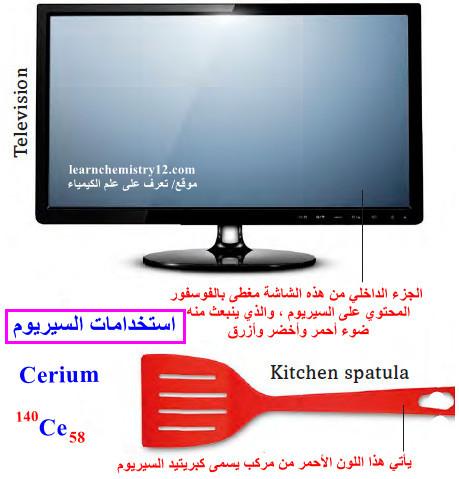
(5) الاستخدام الرئيسي للسيريوم هو صنع الفوسفور، وهي مواد كيميائية تنتج أضواء بألوان مختلفة. توجد الفوسفور في أجهزة التلفاز ذات الشاشات المسطحة والمصابيح.
(6) يستعمل في بصريات الوقاية، فالزجاج الحاوي عليه يمتص الإشعاع فوق البنفسجي، لأن العينات الحاوية على السيريوم توفر للعين وقاية ناجحة تماماً.
(7) كما إن جميع هذه التطبيقات تؤدي إلى استهلاك محسوس للسيريوم.
(8) السيريوم شديد السمية عندما يكون نقيًا، لكن مركبات السيريـوم الأكثر أمانًا لها بعض الاستخدامات.
– المراجع:
- دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر.
- The periodic table book – A visual Encyclopedia of elements written by Tom Jackson – consultant Jack Challoner – Great Britain 2017








اريد مرجع عربي علمي يتحدث عن الجلسرين بشكل متوسع