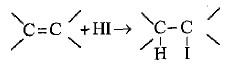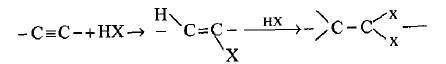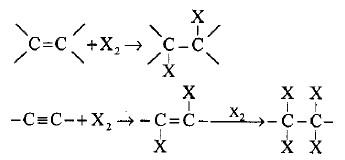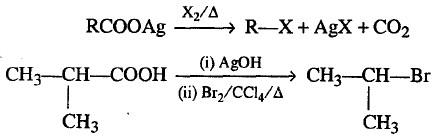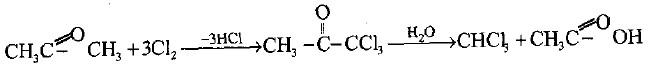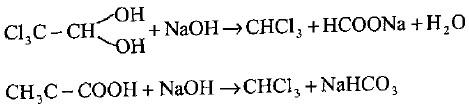تحضير هاليدات الألكيل
– في هذا الموضوع سنتطرق إلى الطرق الشائعة لتحضير هاليدات الألكيل بالتفاعلات والأمثلة.
تعريف هاليدات الألكيل Alkyl Halides
– هاليدات الألكيل هي المشتقات الهالوجينية للألكانات.
– وهي الهيدروكربونات المشبعة (البارافينات) والتي تم فيها استبدال ذرة هيدروجين أو أكثر بذرة هالوجين (X) والتي تتمثل بالصيغة العامة CnH2n+1X.
– تسمى الهاليدات أما باعتبارها بارافينات استبدلت فيها ذرة هيدروجين بذرة هالوجين لذا يتم تسميتها هاليدات الألكيل أو يمكن اعتبارها مشتقات لهاليدات الهيدروجين تم استبدال ذرة الهيدروجين بمجموعة الكيل وكما يلي:
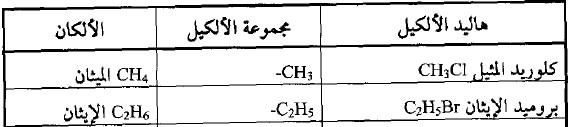
– مثل هاليدات الميثيل أو هاليدات الأيثيل وبذلك تعتبر مشتقات للميثان والايثان وغيرها من الألكانات.
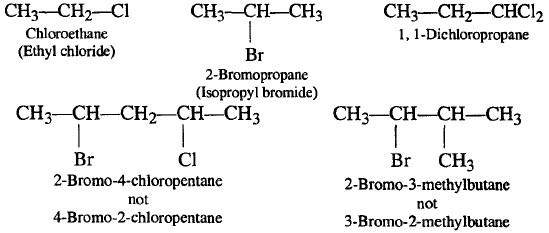
– مثل بقية الهيدروكربونات فأنها تكون مركبات أيزومرية في الهاليدات الكبيرة وتزداد هذه الأيزومرات بازدياد عدد ذرات كربون المجموعة الألكيلية.
– كما يمكن أن تكون هنالك هاليدات أحادية وثنائية وثلاثية ورباعية ومتعددة (حسب عدد ذرات الهالوجين) كما يلي:
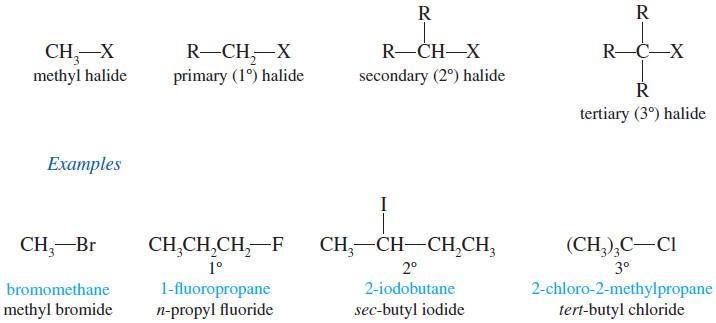
– وقد تكون هاليدات أولية وثانوية أو ثالثية (حسب نوع ذرة الكربون المتصل بها الهالوجين) كما يلي:
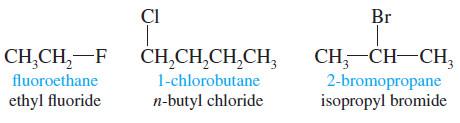
أمثلة على هاليدات الألكيل
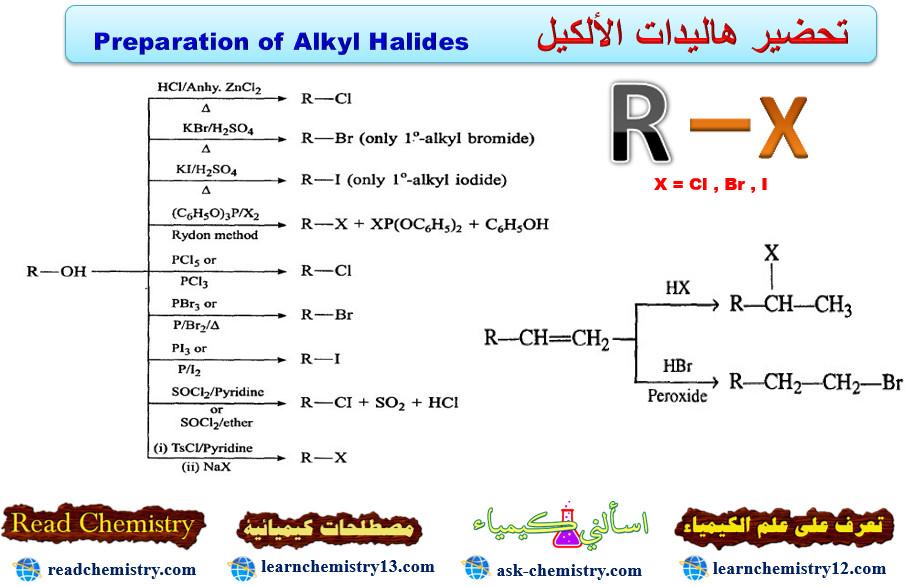
طرق تحضير هاليدات الألكيل
– بشكل عام فأن تحضير هاليدات الألكيل يتم بواسطة أما من الكحولات المقابلة باستبدال مجموعة الهيدروكسيل بذرة هالوجين أو بالاستبدال المباشر لذرة هيدروجين الألكانات بذرة أو أكثر من الهالوجين.
– فيما يلي الطرق الشائعة لتحضير هاليدات الألكيل كما يلي:
(1) هلجنة الألكانات Halogenation of Alkanes
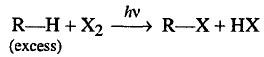
– يمكن تحضير الكلوريدات والبروميدات بالتفاعل المباشر للهالوجين مع الألكان بوجود الضوء أو الحرارة غير أن هذه الطريقة ليست عملية وذلك لعدم إمكانية التحكم في التفاعل مما يؤدي إلى إنتاج خليط من المركبات متعددة الهالوجين.
– عند إمرار خليط من غاز الكلور وغاز الميثان في أنبوبة ساخنة فأن المركب الناتج هو كلوريد المثيل مع إمكانية استمرار التفاعل واستبدال ذرات هيدروجين أخرى عند حفز التفاعل بإضافة كلوريد الحديديك أو عدة بلورات من اليود وتسمى هذه المواد بحاملة الهالوجين (Halogen carriers).
– يتفاعل غاز البروم بنفس الطريقة السابقة ولكن بسرعة أبطأ
– لا يمكن الحصول على يوديد المثيل بنفس الطريقة لأن التفاعل يؤدي إلى تكوين حامض الهيدرويوديك يوديد HI وهو عامل مختزل فعال حيث يتفاعل مع يوديد المثيل الناتج ويعكس التفاعل ويعطي المواد المتفاعلة مرة ثانية.
– أما الفلورة المباشرة فهي صعبة الحدوث لأن التفاعل ذو طابع إنفجاري لذا يفضل إجراؤه في الظلام ومع ذلك فأن النواتج ليست فلوريد المثيل وإنما الكربون وحامض الهيدروفلوريك.
CH4 + F2 → C + 4HF
– يعتبر هذا التفاعل طريقة لتحضير الحامض الذي يستعمل في الحفر على الزجاج
– تفاعل الفلورة يمكن أن يتم حينما يخفف الفلور مع غاز النتروجين وبوجود حفازات مناسبة مثل ثلاثي فلوريد الكوبلت CoF3 حيث يتكون مزيج من الهيدروكربونات المفلورة.
– تتم ميكانيكة تفاعل هلجمة الالكانات بواسطة الشق الحر لذلك تسمى Free-Radical Halogenation
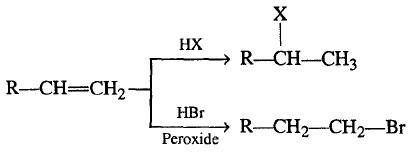
(2) إضافة هاليد الهيدروجين للألكينات Hydrohalogenation of Alkenes
– تحضر هاليدات الألكيل من تفاعل هاليد الهيدروجين (أو الأحماض الهالوجينية) مع الألكينات.
– يظهر حامض الهيدرويوديك ميلاً شديداً للتفاعل على عکس حامض الهيدروكلوريك أو حامض هيدروبروميك.
– أما إذا كانت الرابطة الثنائية غير متناظرة فيتم التفاعل والإضافة وفق قاعدة ماركونيكوف وعكس القاعدة في حالة وجود البيروكسيد.
– في حالة إضافة هاليد الهالوجين إلى الرابطة الثلاثية فأن الناتج يكون الهاليد الفاينيلي أولاً ثم بإضافة الجزيئة الثانية يتكون ثنائي الهاليد التوأمي geminal halide.
(3) إضافة الهالوجين إلى الرابطة غير المشبعة
– تضيف الرابطة الثنائية والرابطة الثلاثية الكلور والبروم بجزيئة واحدة للأولى وجزيئيتين للثانية لتكوين ثنائي الهاليد ورباعي الهاليد على التوالي من خلال ميكانيكية الأيون الجسري لإعطاء ثنائي الهاليد المتجاور أو المتقابل حسب حجم ذرة الهالوجين.
– أما في حالة الرابطة الثلاثية فيتكون رباعي الهاليد المتجاور كما بالتفاعلات الآتية:
(4) تفاعل الكحولات مع هاليد الهيدروجين
– تتفاعل الكحولات مع هاليدات الهيدروجين في تفاعل محفز بالحامض المعدني HX.
– تعتمد سرعة التفاعل على طبيعة وصنف الكحول المتفاعل كما تعتمد كذلك على الهاليد المستخدم كما يلي:
- فعالية الكحولات بنزيلية والليلية : °3 > 1o > 2o
- فعالية هاليد الهيدروجين: HF < HCl < HBr < HI
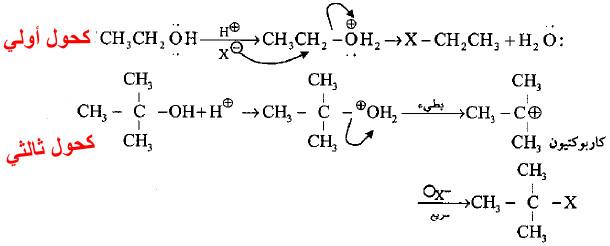
– تعتمد ميكانيكية التفاعل على صنف الكحول المتفاعل حيث تتفاعل الكحولات الأولية بميكانيكية تختلف عما تتفاعل به الكحولات الثانوية والثالثية.
– الميكانيكية في الحالة الأولى (الكحول الأولي) تتم المهاجمة والمغادرة من قبل الهاليد والماء بعد خطوة التحميض ودون تكوين الكاربوكتيون في خطوة سريعة تعتمد على تركيز كل من الهاليد والهالوجين (تفاعل من الدرجة الثانية) ويدعى استبدال نيوكليوفيلي من الدرجة الثانية Substitution Nucleophilic bimolecular ويرمز له SN2.
– أما في حالة الكحول الثالثي فأن الكحول المحمض يعاني من فقدان جزيئة ماء أولاً لتكوين الكاربوكاتيون في خطوة بطيئة (الخطوة المحددة للتفاعل) ثم مهاجمة الهاليد السالب –X للكربوكتيون في خطوة سريعة وهنا يتحكم تكون الكربوكتيون في سرعة التفاعل وبذلك يعتمد التفاعل على تركيز الهاليد فقط (تفاعل استبدال نيوكليوفيلي أحادي الجزيئية Substitution Nucleophilic unimolecular ويرمز له SN1.
– وفيما يلي أمثلة على تحضير هاليدات الألكيل من الكحولات بميكانيكة تفاعلات الاستبدال النيكلوفيلية Substitution Nucleophilic reaction
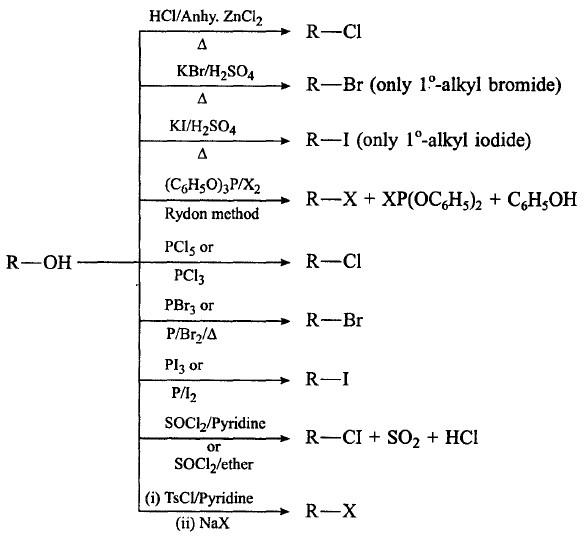
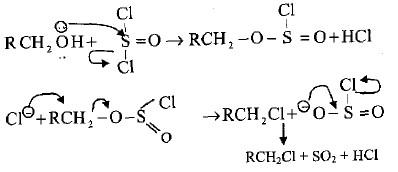
(5) تفاعل الكحولات مع الهاليدات الكبريتية والفسفورية
– تتفاعل الكحولات الأولية والثانوية مع كلوريد الثايونيل (SOCl2) بسهولة لإعطاء كلوريد الألكيل المقابل بمنتوج عالي ونقي لأن بقية المركبات الناتجة مع الهاليدات تكون غازات تتطاير في الهواء.
R-OH + SOCl2 → R -Cl + SO2 + HC1
– من الممكن تسريع التفاعل بإضافة أمين ثالثي يتفاعل مع كلوريد الهيدروجين المتحرر ويدفع بالتفاعل إلى اليمين.
– تكون ميكانيكية التفاعل كما يلي:
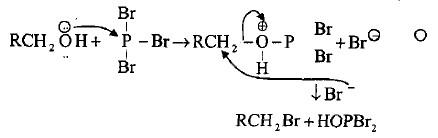
– أما تفاعل الكحول مع ثلاثي بروميد الفسفور فأنه يؤدي إلى تكوين هاليد الألكيل وحامض الفسفوروز وفق الميكانيكية كما يلي:
– المركب الناتج ثنائي برومو فوسفايت الحامضي يمكنه التفاعل مع جزئيتين من الكحول لإعطاء جزيئتين من الهاليد، أي أن التفاعل 3 مول كحول + 1 مول ثلاثي بروميد الفسفور.
(6) تفاعل هونسديكر Hunsdiecker Reaction
– املاح الفضة للاحماض الكربوكسيلية تتفاعل مع الهالوجين X2 في وجود راب كلوريد الكربون CCl4 هاليد الالكيل كما يلي:
– فى هذا التفاعل يتم استبدال مجموعة الكربوكسيل COOH) carboxylic group-) بمجموعة الهالوجين halo group.
– قد يسمى هذا التفاعل ايضاً Borodine-Hunsdiecker Reaction تفاعل بورودين هونسديكر.
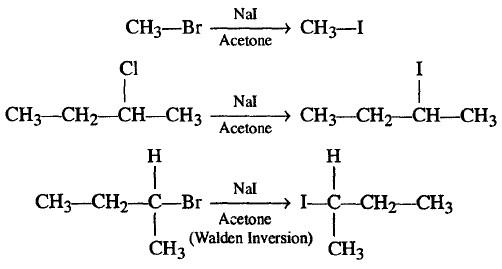
(7) تفاعل فينكلشتاين Finkelstein Reaction
– تتفاعل كلوريد الالكيل أو بروميد الألكيل مع يوديد الصوديوم NaI فى وجود الأسيتون ليعطى يوديد الألكيل.
– هذا التفاعل يستخدم أساساً لتحويل كلوريد الالكيل أو بروميد الألكيل إلى يوديد الألكيل.
– تسير ميكانيكة التفاعل حسب Substitution Nucleophilic bimolecular SN2.
– قد يسمى هذا التفاعل أيضاً Conant-Finkelstein Reaction
(8) تفاعل سوارت Swart Reaction
– تتفاعل هاليدات الألكيل (بروميد الألكيل أو كلوريد الألكيل) مع AgF, SbF3 or Hg2F2 ليعطي فلوريد الألكيل.
– هذا التفاعل يستخدم فى تحضير فلوريد الالكيل.
تحضير الهاليدات المتعددة Polyhalogenated Hydrocarbons
– أهم المركبات في هذا الصنف هي هاليدات المثيلين (Methylene halides) ومركبات الهالوفورم (الكلوروفورم، الأيودوفورم والبروموفورم)، رابع كلوريد الكربون، رابع بروميد الكربون.
– تحضر الهاليدات المتعددة بالطرق التالية:
(1) تحضير هاليدات الميثيلين CH2X2
– يمكن الحصول على هاليدات المثيلين (CH2X2) بالاختزال الجزئي لمركبات الهالوفورم لذا فإن يوديد المثيلين يحضر بمنتوج عالي من اختزال الأيودوفورم مع محلول زرنیخات الصوديوم القاعدية.
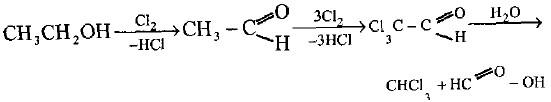
– وكما مر علينا سابقاً فأن كلوريد المثيلين يمكن تحضيره من كلورة الميثان بوجود الحرارة أو ضوء الشمس بشرط التحكم بالنواتج وكميات المواد المتفاعلة.
(2) تحضير الكلورفورم CHCl3
– يحضر الكلورفورم CHCl3 صناعياً بالطرق التالية إضافة إلى كلورة الميثان:
(أ) بتأثير المسحوق القاصر (Bleaching powder) وهو أوكسي كلوريد الكالسيوم CaOCl2 على الايثانول أو الأسيتون في المحلول المائي حيث يكون التأثير مضاعفاً.
– التأثير الأول هو سحب الهيدروجين من الايثانول وتحويله إلى اسيتالدهيد يتبعه كلورة الأخير إلى مركب الكلورال (ثلاثي كلورو اسپتالدهيد) والذي يتحلل قاعدياً إلى الكلوروفورم وفورمــات الكالسيوم (ليبيبح وسوبيران Liebig & Saabeiran).
– أما في حالة الأسيتون فأن الخطوة الأولى هو تكوين ثلاثي كلورو أسيتون والذي يتحلل مائياً مع القاعدة إلى الكلوروفورم وأسيتات الكالسيوم.
– يمكن تحضير البروموفورم والأيودوفورم بنفس الطريقة السابقة.
(ب) يمكن الحصول على الكلور فورم النقي بتسخين الكلورال الجاف (Chloral hydrate) أو ثلاثي كلورو حامض الخليك مع القاعدة.
(3) تحضير الأيودوفورم صناعياً
– صناعياً يمكن تحضير الأيودوفورم بالتحلل الكهربائي لمحلول مائي – كحولي أو مائي – أسيتون مع يوديد البوتاسيوم في حرارة 60-70°م مع إمرار تيار من ثاني أوكسيد الكربون في المحلول للمحافظة على ثبات الحامضية.
– ينطبق ذلك على تحضير البروموفورم.
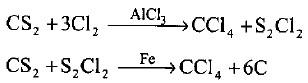
(4) تحضير رابع كلوريد الكربون CCl4 تجارياً
– يحضر رابع كلوريد الكربون CCl4 تجارياً أما بكلورة الميثان كاملاً أو بتأثير الكلور أو كلوريد الكبريت S2Cl2 على ثنائي كبريتيد الكربون بوجود حفاز (AlCl3, Fe).
– يمكن تحضير رابع بروميد الكربون بنفس الطريقة.
المراجع
- الكيمياء العضوية الإليفاتية – د/ عادل شاكر الطائي – دار المسيرة للنشر والتوزيع – عمان – الأردن – 2009
- Organic chemistry / L.G. Wade, Jr / 8th ed, 2013 / Pearson Education, Inc. USA.
- Unergraduate Organic Chemistry /Dr. Jagdamba Singh, Dr. L.D.S Yadav / 1st ed, 2010/ Pragati prakashan Educational Publishers, India.
- Organic chemistry / William H. Brown , Christopher S. Foote , Brent L. Iverson , Eric V. Anslyn , Bruce M. Novak . ( sixth edition ) . United States