الكيمياء الفيزيائية
الكيمياء الفيزيائية تدمج بين الكيمياء والفيزياء، تدرس سلوك المواد على المستوى الجزيئي والذري. تركز على الطاقة، الديناميكا الحرارية، الحركية الكيميائية، وتفسير الظواهر الكيميائية نظريًا وتجريبيًا.
-
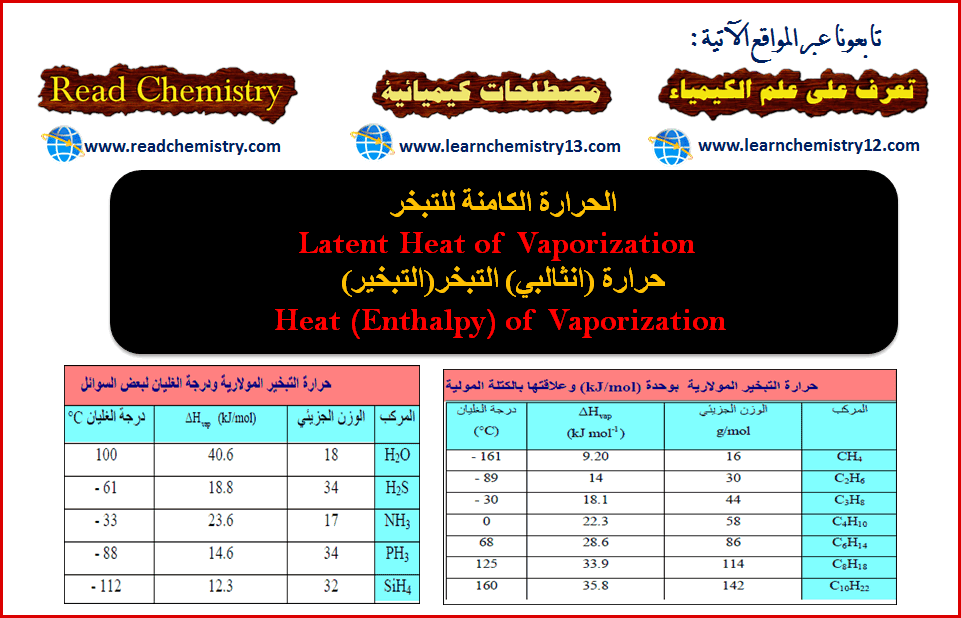
الحرارة الكامنة للتبخر (حرارة التبخير) Enthalpy of Vaporization
الحرارة الكامنة للتبخر Latent Heat of Vaporization حرارة (انثالبي) التبخر(التبخير)Heat (Enthalpy) of Vaporization – نفرض أننا وضعنا قدراً من سائل…
أكمل القراءة » -
الغليان ودرجة الغليان Boiling and Boiling Point
الغليان ودرجة الغليان Boiling Point – عند تسخین سائل ما تبدأ بعض فقاعات البخار في التكون في وسط السائل، وتحتوي كل…
أكمل القراءة » -
وحدات القياس و الثوابت الفيزيائية والكيميائية التى تحتاجها فى دراستك
في هذا الموضوع سوف نستعرض أهم وحدات القياس المستخدمة فى الفيزياء والكيمياء وكذلك أهم الثوابت الفيزيائية والكيميائية التى تحتاجها أثناء…
أكمل القراءة » -
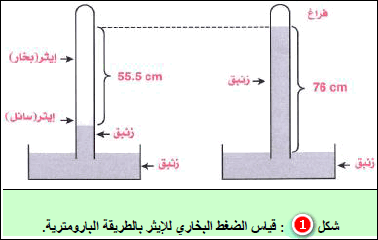
قياس الضغط البخاري Measurement of Vapour Pressure
تعريف الضغط البخاري Vapour Pressure – هو الضغط الناتج من جزیئات بخار السائل الموجود في وعاء مغلق . – لكل سائل…
أكمل القراءة » -
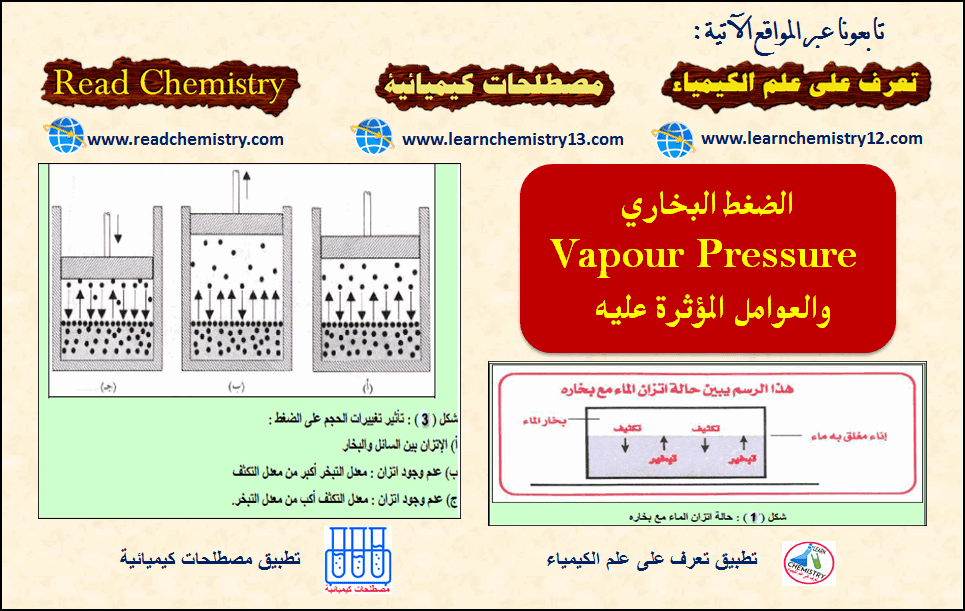
الضغط البخاري Vapour Pressure والعوامل المؤثرة عليه
ضغط بخار السائل Liquid Vapour Pressure – الضغط البخاري لكل من الصلب والسائل ھو مقیاس لمیل المادة للتبخیر. – فلو…
أكمل القراءة » -
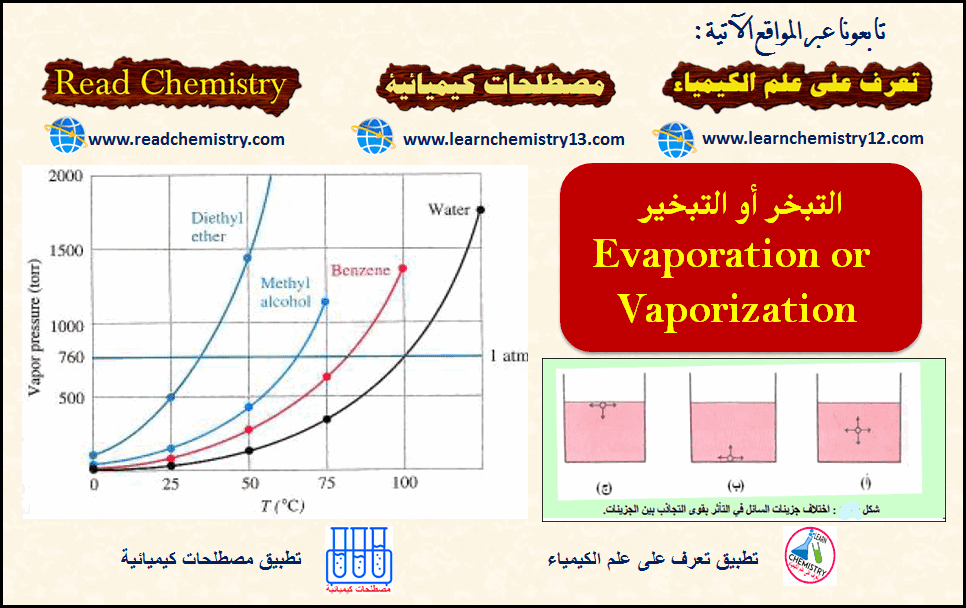
التبخر أو التبخير Evaporation or Vaporization
تبخر السائل Vaporization of liquid – نعرف جمیعاً أن الملابس المبللة بالماء، عند تعلیقھا في الھواء، تفقد ما بھا من…
أكمل القراءة » -
قوى التجاذب بين جزئيات السائل Intermolecular Forces
توجد قوى التجاذب بين جزئيات السائل وتكون أضعف بكثير من الرابطة التساھمیة التي تربط بین الذرات في الجزيء، فمثلاً الطاقة…
أكمل القراءة » -
قوى لندن التشتتية London Dispersion Forces (قوى فان درفالز)
هناك قوى تجاذب بين جزئيات السائل ، وهذه القوى أضعف بكثير من الرابطة التساھمیة التي تربط بین الذرات في الجزيء،…
أكمل القراءة » -
قائمة بأهم موضوعات الكيمياء الحرارية Thermochemistry
مقدمة عن الكيمياء الحرارية Introduction of Thermochemistry – یعتبر إنتاج الطاقة واحداً من أھم المزایا التي ترافق وتمیز التفاعلات…
أكمل القراءة » -
قائمة بأهم موضوعات الديناميكا الحرارية (الثيرموديناميك)
مقدمة عن الديناميكا الحرارية Introduction of Thermodynamic – توجد أنواع كثیرة من الطاقة مثل الطاقة الحراریة، الطاقة الكھربیة، الطاقة المیكانیكیة،…
أكمل القراءة » -
الطاقة الحرة Free Energy والإتزان الكيميائي
العلاقة بين رائز التفاعل (Q) والطاقة الحرة (ΔG) حيث: R= ھي الثابت العام للغازات وقیمته (8.314 J/mol K)…
أكمل القراءة » -
مسائل محلولة على العلاقة بين الإنثالبي والأنتروبي والطاقة الحرة
فى هذا الموضوع سوف نستعرض (8) مسائل بأفكار مختلفة على العلاقة بين الإنثالبي والأنتروبي والطاقة الحرة حيث قمنا بعرض الإجابات…
أكمل القراءة » -
طاقة جبس الحرة Gibbs Free Energy
طاقة جبس الحرة Gibbs Free Energy – طاقة جبس الحرة هي خاصية ثيرموديناميكية تجمع بين أنتروبي وإنثالبي النظام من أجل تحديد…
أكمل القراءة » -
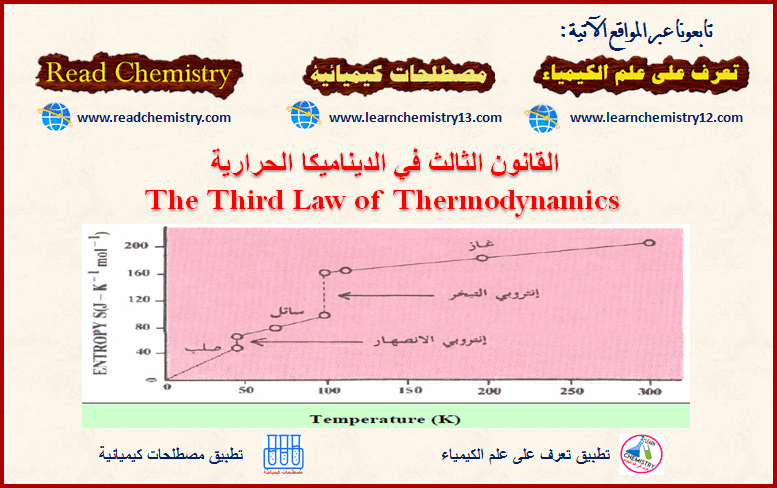
القانون الثالث للديناميكا الحرارية 3th Law of Thermodynamics
القانون الثالث للديناميكا الحرارية (الأنتروبي القياسي Standard Entropy) – ينص القانون الثالث للديناميكا الحرارية على أن: (الأنتروبي لأي مادة نقیة…
أكمل القراءة » -
القانون الثاني في الثيرموديناميك (الديناميكا الحرارية)
فى هذا الموضوع أن شاء الله سوف نقوم بشرح القانون الثاني للديناميكا الحرارية (الثيرموديناميك) القانون الثاني في الثيرموديناميك – ویمكن…
أكمل القراءة » -
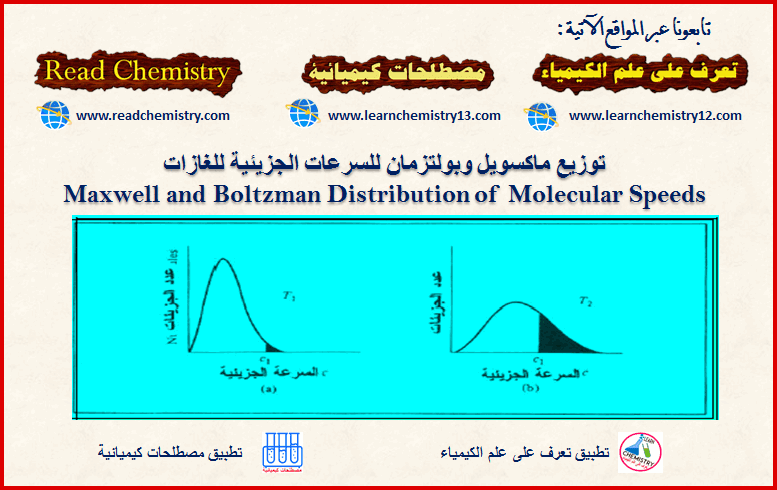
السرعات الجزیئیة للغازات: توزيع ماكسويل- بولتزمان
فى هذا الموضوع سنقوم بشرح السرعات الجزیئیة للغازات – توزيع ماكسويل وبولتزمان Maxwell and Boltzman Distribution مقدمة عن السرعات الجزيئية…
أكمل القراءة » -
ما هو الأنتروبي ?What is ENTROPY
تعريف الأنتروبي Definition of Entropy (1) الأنتروبي Entropy والذي يرمز له بالرمز (S) هو: مقياس مباشر لخاصية عدم الانتظام (درجة الفوضى –…
أكمل القراءة » -
العمليات التلقائية – القانون الثاني للديناميكا الحرارية
من القانون الأول للدینامیكا الحراریة علمنا أنه إذا كان ھناك جسمان أحدھما ساخن والآخر أقل منه في درجة الحرارة…
أكمل القراءة » -
الطاقة الداخلية ΔE والإنثالبي Enthalpy ΔH + مسائل محلولة
في هذا الموضوع سوف ندرس العلاقة بين الطاقة الداخلية والإنثالبي Internal Energy and Enthalpy ، وجدير بالذكر أننا قد تكلمنا في…
أكمل القراءة » -
تحميل كتاب تكنولوجيا النانو باللغة العربية تأليف/ محمد شريف الإسكندراني
إستكمالأ لقائمة الكتب الكيميائية الرائعة والمختلفة الذي يقوم موقعنا بتوفيرها للأعضاء الكرام، نقدم لكم في هذا الموضوع كتاب غاية…
أكمل القراءة »