أولاً: ما هو عنصر الفوسفور؟ What is Phosphorus element – هوعنصر من عناصر الجدول الدوري ، العدد الذري= 15 العدد الكتلي = 31 – التوزيع الإلكتروني له : 1S2 , 2S2 2P6 , 3S2 3P3 – هو عبارة عن عنصر لا فلز ، له عدة أشكال متأصلة أهمها الفوسفور …
أكمل القراءة »معلومات هامة جداً عن عنصر السيليكون Silicon
أولاً/ ما هو عنصر السيليكون؟ What is Silicon element – هو عنصر من عناصر الجدول الدوري ، العدد الذري له = 14 ، والعدد الكتلي = 28 – التوزيع الإلكتروني له : 1S2 , 2S2 2P6 , 3S2 3P2 – هو عنصر شبه معدن (شبة فلز) رمادي اللون، قاس …
أكمل القراءة »معلومات هامة جداً عن عنصر الألومنيوم Aluminium
أولاً/ ما هو عنصر الألومنيوم؟ What is Aluminium element – هو عنصر من عناصر الجدول الدوري ، العدد الذري له = 13 ، والعدد الكتلي = 27 – التوزيع الإلكتروني لعنصر الألومنيوم: 1S2 , 2S2 2P6 , 3S2 3P1 – هو عبارة عن معدن لونه أبيض فضي خفيف، قابل للسحب …
أكمل القراءة »معلومات هامة جداً عن عنصر الماغنسيوم Magnesium
أولاً/ ما هو عنصر الماغنسيوم؟ What is Magnesium element – هو عنصر من عناصر الجدول الدوري يرمز له بالرمز (Mg) ، العدد الذري= 12 العدد الكتلي = 24 – التوزيع الإلكتروني لعنصر الماغنسيوم 1S2 , 2S2 2P6 , 3S2 – عبارة عن معدن، ينتمي إلى مجموعة المعادن القلوية الترابية …
أكمل القراءة »معلومات هامة جداً عن عنصر الصوديوم Sodium
أولاً/ ما هو عنصر الصوديوم؟ What is Sodium element – هو عنصر من عناصر الجدول الدوري يرمز له بالرمز (Na) ، العدد الذري = 11 ، والعدد الكتلي = 23 – التوزيع الإلكتروني له: 1S2 , 2S2 2P6 , 3S1 – هو معدن خفيف ذو لون فضي أبيض ، شديد الفعالية …
أكمل القراءة »معلومات هامة جداً عن عنصر النيون Neon
أولاً/ ما هو عنصر النيون؟ What is Neon element – النيون عنصر من عناصر الجدول الدوري ينتمي إلى مجموعة الغازات النبيلة. – العدد الذري له = 10 ، والعدد الكتلي = 20 – يرمز له بالرمز (Ne) – التوزيع الإلكتروني لعنصر النيون 1S2 , 2S2 2P6 – (Ne) هو عنصر …
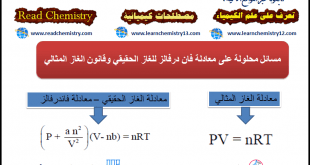
أكمل القراءة »مسائل محلولة على معادلة فان درفالز للغاز الحقيقي وقانون الغاز المثالي
مثال (1) احسب الضغط الذي یؤدیه mol 1.0 من بخار الماء في حجم قدره 20.0 L عند Co 27.0 باستخدام: (أ) قانون الغاز المثالي (ب) معادلة فان درفالز: علماً بأن قیم ثوابت فان درفالز: (a = 5.464 L2 atm mol-2, b = 0.03049 L mol-1 ) الحل: (أ) باستخدام قانون الغاز …
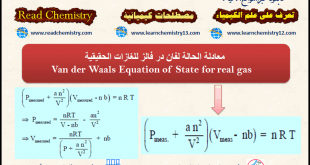
أكمل القراءة »معادلة الحالة فان در فالز لوصف حالة الغاز الحقيقي
معادلة الحالة لفان در فالز van der Waals Equation of State – هي معادلة سميت باسم واضعها العالم الهولندي يوهانس ديديريك فان دير فالس. وهي معادلة الحالة تقريبية تصف حالة الغازات الحقيقية. تأخذ معادلة فان دير فالس في اعتبارها اختلاف الغاز الحقيقي عن الغاز المثالي . – العلاقة التالية (القانون …
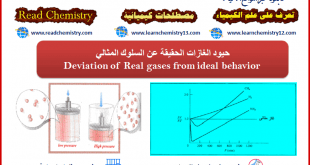
أكمل القراءة »حيود الغازات الحقيقية عن السلوك المثالي للغازات المثالية
حيود الغازات الحقيقية عن السلوك المثالي – من قانون بويل: P V = Constant ومن القانون العام للغازات فإن: P V = n R T وبالتالي فإنه عند أي ظرف فإن: وھذا یعني أنه في حالة تغییر الضغط عند درجة حرارة ثابتة لنفس الكمیة فإن …
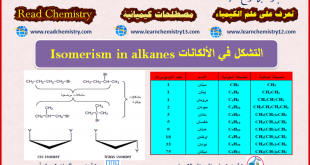
أكمل القراءة »التشكل في الألكانات Isomerism in alkanes
التشكل البنائي في الألكانات Structural isomerism in alkanes – أن التشكل البنائي Structural isomerism ظاهرة واسعة الانتشار في المركبات العضوية وتعنى وجود اكثر من صيغة بنائية لصيغة جزيئية واحدة. – ينقسم التشكل البنائي عموماً إلى ثلاث أنواع كما يلي: (1) متشكلات السلسلة Chain isomerism (2) المتشكلات الموضعية Positional Isomerism (3) …
أكمل القراءة »تعيين عيارية وقوة HCl , NaCl في مخلوط منهما باستخدام AgNO3
الأساس النظري (1) تتم معایرة حمض الهیدروكلوریك HCl فقط باستخدام محلول قياسي من هيدروكسيد الصوديوم NaOH ویتم تعیین حجم هیدروكسید الصودیوم المكافئ للحمض. (2) یتم معایرة حجم جدید من الخلیط مضاف إلیه حجم هیدروكسید الصودیوم المكافئ للحمض ثم یضاف قطرات من دلیل كرومات البوتاسیوم K2CrO4 ثم تجرى عملیة المعایرة بواسطة محلول …
أكمل القراءة »المذيبات في الكيمياء العضوية Solvents in organic chemistry
تعريف المذيبات العضوية Organic Solvent المذيب عبارة عن سائل يستخدم في إذابة المركبات وتعتبر المذيبات مهمة جداً في التجارب العملية حيث أنها تؤثر على حمضية وقاعدية المحاليل لذا يجب فهم الذوبانية ودور المذيب وتأثيراته على معدلات التفاعل قبل اختياره ولفهم هذه التأثيرات يجب معرفة تصنيف المذيبات. تصنيف المذيبات العضوية classification …
أكمل القراءة »تعيين عيارية NaCl باستخدام محلول قياسي من AgNO3 – طريقة فولهارد
في هذا الموضوع سيتم تعیین عیاریة وقوة كلورید الصودیوم بواسطة محلول قياسي من نترات الفضة باستخدام طريقة فولهارد Volhard’s method الأساس النظري لطريقة فولهارد – طريقة فولهارد هى أحدى طرق تحديد نقطة النهاية فى المعايرات الترسيبية – یتم أستخدام طريقة فولهارد لتقدیر أیون الكلورید في الوسط الحمضي ولیس الوسط …
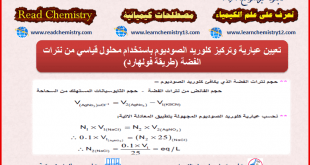
أكمل القراءة »تعیین عیاریة AgNO3 باستخدام محلول قياسي NaCl بطريقة موهر و فاجان
في هذا الموضوع سيتم تعیین عیاریة وقوة نترات الفضة باستخدام محلول قياسي من كلوريد الصوديوم وذلك بطريقتين: (أ) باستخدام طريقة موهر Mohr’smethod (ب) باستخدام طريقة فاجان Fajan’smethod Determination of Normality and Strength of AgNO3 by standard solution NaCl of by using Mohr’s and Fajan’s Methods أولاً/ معايرة محلول …
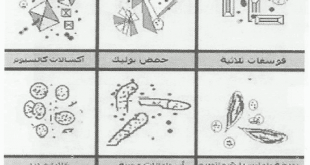
أكمل القراءة »الفحص الميكروسكوبي لعينات البول Examination of Urine
طريقة الفحص الميكروسكوبي للبول (1) نأخذ حوالي 10 مل من البول في أنبوبة. (2) ثم نضع الأنبوبة في جهاز السنتر فيوج (الطرد المركزي) وتدار عند السرعة الأول لمدة 2 – 3 دقيقة. (3) نأخذ الراسب ويفحص على شريحة زجاجية تحت الميكروسكوب. – الشكل التالي يوضح صور تقريبية للأشكال …
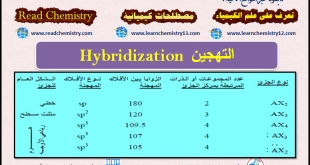
أكمل القراءة »التهجين فى الكيمياء Hybridization in Chemistry
تعريف التهجين Hybridization يعطى التهجين تفسيراً لطبيعة الأفلاك الذرية وكيفية اتحادها لتكوين الأفلاك الجزيئية وهى عبارة عن عملية تداخل بين أفلاك الذرة الواحدة المتقاربة في الطاقة ينتج عنها افلاك جديدة متساوية في الطاقة والشكل. تعريف الفلك الجزيئي Molecular orbital – يصف الفلك الجزيئي حيزاً من الفراغ تتحرك فيه الإلكترونات ويشمل …
أكمل القراءة »خواص المركبات العضوية Properties of organic compounds
أولاً/ خواص المركبات العضوية properties of Organic Compounds تتميز تلك المركبات بالخواص التالية: (1) جميعها مركبات جزيئية حيث تحتوي على وحدات متميزة يتألف كل منها من عدد محدود من الذرات ولا توجد بينها أيونات وتدعي الجزيئات (Molecule) (2) سهلة التطاير في الحالة السائلة وذات درجات إنصهار منخفضة إذا …
أكمل القراءة »قائمة بأهم موضوعات الكيمياء الحرارية Thermochemistry
مقدمة عن الكيمياء الحرارية Introduction of Thermochemistry – یعتبر إنتاج الطاقة واحداً من أھم المزایا التي ترافق وتمیز التفاعلات الكیمیائیة. فكل تفاعل كیمیائي یخضع لقانونین رئیسین ھما : قانون حفظ المادة، وقانون حفظ الطاقة. – فعندما یأكل شخص ما الحلوى فإن محتویاتھا ، وخصوصاً السكر، تتفاعل مع الأكسجین لإنتاج …
أكمل القراءة »قائمة بأهم موضوعات الديناميكا الحرارية (الثيرموديناميك)
مقدمة عن الديناميكا الحرارية Introduction of Thermodynamic – توجد أنواع كثیرة من الطاقة مثل الطاقة الحراریة، الطاقة الكھربیة، الطاقة المیكانیكیة، الطاقة الكیمیائیة، الطاقة المغناطیسیة، الطاقة الحركیة والطاقة السطحیة وغیر ذلك وتحت ظروف معینة یمكن لھذه الأنواع من الطاقة أن تتحول الى بعضھا البعض، وتھتم الدینامیكا الحراریة بالبحث عن العلاقة بین …
أكمل القراءة »الطاقة الحرة Free Energy والإتزان الكيميائي
العلاقة بين رائز التفاعل (Q) والطاقة الحرة (ΔG) حيث: R= ھي الثابت العام للغازات وقیمته (8.314 J/mol K) Q= رائز (كسر التفاعل) والذي ینتج من تعویض التراكیز الإبتدائیة في تعبیر ثابت الإتزان K: والحرف السفلي [ ]o یعني التراكیز الإبتدائیة. (1) إذا كانت قیمة كبیرة …
أكمل القراءة » تعرف على علم الكيمياء
تعرف على علم الكيمياء