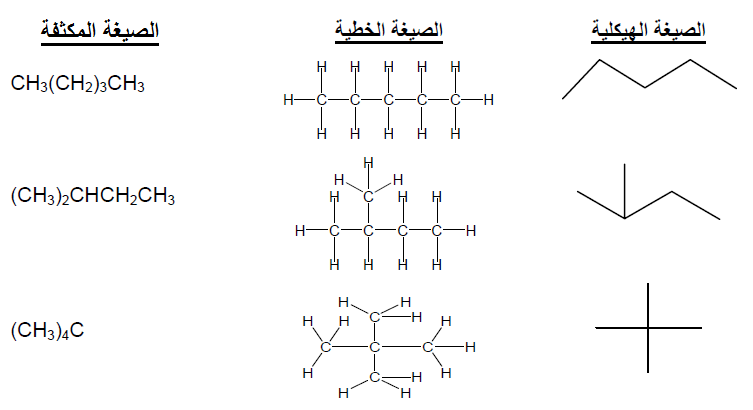
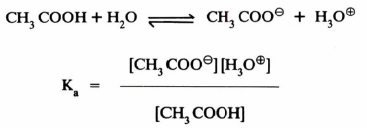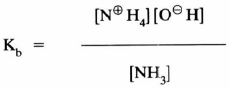حموضة الاحماض وقاعدية القواعد
حموضة الاحماض وقاعدية القواعد
– في هذا الموضوع سوف نتكلم عن حموضة الاحماض وقاعدية القواعد وكيف يمكن التفرقة بين الأحماض القوية والضعيفة وكذلك بين القواعد القوية والضعيفة.
أولاً/ تعريف الأحماض والقواعد
– تم تعـريف الأحماض والقـواعـد بعـدة تـعـريفـات:
(1) تعريف أرهينيوس للأحماض والقواعد
– فلقد عرف العالم أرهينيس Arrhenius الأحماض بأنها تلك المركبات التي لها قدرة على إعطاء أيون هيدروجين (بـروتـون +H) في المحلول بينها القواعد هي تلك المركبات القادرة على إعطاء أيون هيدوكسيل OH في المحلول .
– ويعتبر الكيميائيون هذا التعريف للأحماض والقواعد كافياً إذا أجرى التفاعل في وسط مائي وهو لا يتوفر لكثير من التفاعلات العضوية .
(2) تعريف برونستيد – لوري للأحماض والقواعد
– يعتبر تعريف برونستيد ـ ولورى Bronsted-Lowry للأحماض والقواعد أكثر شمولاً إذ تعرف الأحماض بالمواد القادرة على إعطاء بروتون (مثل: HNO3 , HC1) والقواعد بالمواد القادرة على ضم بروتون (مثل: OH, NH3–)
(3) تعريف لويس للأحماض والقواعد
– وبـالـرغم من أن كثيراً من تفاعلات الأحماض والقواعد تخضع لانتقال أيون هيدروجين من الحمض إلى القاعدة إلا أنه وجد أن بعض أنواع هذه التفاعلات لا يحدث فيها انتقال بروتون .
– ومن هذا المنطلق فقد طور العالم لويس Lewis الأحماض والقـواعـد فقـال بأن الأحماض هي تلك المواد القادرة على ضم زوج من الإلكترونات (مثل: AlCl3 , FeCl3) بينها القواعد هي المواد التي لها قدرة على إعطاء زوج من الإلكترونات (مثل: OH, NH3–)
من هذا نرى أن هذه التعريفات للأحماض والقواعد وإن اختلفت شكلاً فإنها تتفق جوهـراً في كون الأحماض مواد فقيرة إلى إلكـتـرونـات بينها القواعد مواد غنية بالإلكترونات.
ثانياً/ حموضـة الأحمـاض
– تتأين الأحماض العضوية في المحاليل المائية بانتقال بروتون منها إلى المذيب ويكون هذا التفـاعـل في حالة اتزان Equilibrium يمكن معه قياس ثابت الاتزان (Ka).
– ويسمى ثابت الاتزان (التأين) للأحماض العضوية الضعيفة بثابت الحامضية (Acidity constant (Ka .
– وتعتبر قيمة ثابت الحموضة مقياساً لقوة الحمض ويمكن حسابه بصفة عامة من المعادلة التالية:
وكلما زادت القيمة العددية لثابت الحمض كلما دل ذلك على زيادة حموضية الحمض.
– وتبين المعادلة التالية ، كيفية حساب ثابت الحامضية لحمض الخل:
وقد حذف تركيز الماء في مقام المعادلة الأخيرة نظرا لبقائه ثابتاً تقريباً.
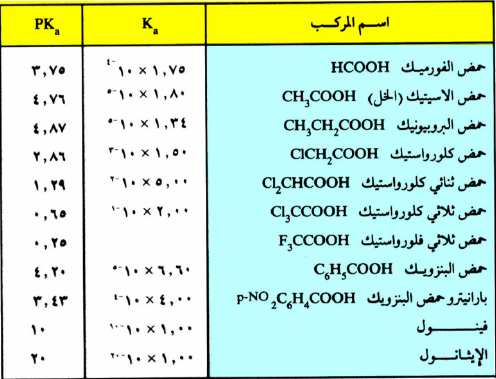
– ولقد وجد من التجارب العملية أن قيمة Ka لحمض الخل تساوي 5-10 × 1.8 وتجنباً لكتابة أرقام كثيرة تشتمل أيضاً على قوة سالبة للعدد عشرة فقد وجد أنه أسهل من الناحية العملية تبسيط قيمة Ka إلى ثابت آخر يسمى pKa وتربطها العلاقة التالية:
فتصبح قيمة pka لحمض الخل 4.76
– ويجب ملاحظة أن حموضة الحمض في حالة استخدام pKa كمقياس للحامضية، أن الحامضية تزداد كلما صغرت قيمة pKa .
– وتتأثر قيمة Ka أو pKa بنوع المذيب المستخدم وكذلك بعوامل أخرى مثل الفعل التحريضي وظاهرة الطنين.
– ويبين الجدول التالي لثوابت الحامضية لبعض الأحماض الكربوكسيلية .
ثالثاً/ قاعـديـة القواعـد
– يعتبر زوج الإلكترونات الحر على ذرة النيتروجين في النشادر مسؤولاً عن خواص القاعدة.
– والنشادر قاعدة ضعيفة تمتزج امتزاجاً تاماً بالماء وتتفاعل معه لتكون أيون الأمونيوم الموجب وأنيون الهيدروكسيل .
– وتسلك القواعد الأخرى مثل الأمينات عند تفاعلها مع الماء مسلكاً مشابهاً مع اختلاف في قاعدية المحلول وفقاً لنوع المادة المذابة.
– ومن الملاحظ أن التفاعل أعلاه تفاعل اتزان يمكن معه إيجاد ثابت الاتزان والذي يعبر عن ثابت القاعدية (Basicity constant(Kb وفقا للمعادلة التالية مع اعتبار أن تركيز الماء ثابت خلال التفاعل .
– ولقد وجد من التجارب العملية أن قيمة Kb للنشادر تساوي 5-10 × 2 عند درجـة 25مo
– وبصفة عامة فإن القاعدية لأي مركب تزداد كلما زادت القيمة العددية للثابت Kb .
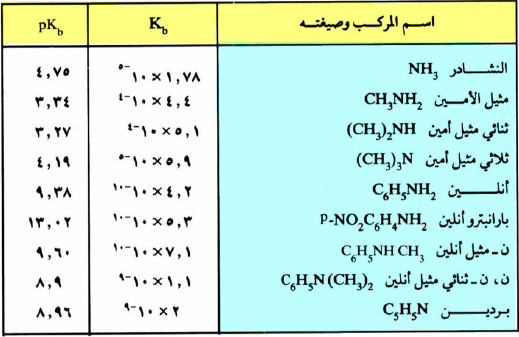
– كذلك يمكن التعبير عن القاعدية بالثابت pKb والذي يمكن حسابه من المعادلة التالية كما يلي:
– وفي حالة استخدام الثابت pKb فإن القاعدية تزداد كلما صغرت القيمة العددية لهذا الثابت.
– والجدير بالذكر أن هناك تلازماً بين قيمة pKa ، وقيمة pKb في المحاليل المائية عند درجـة 25 مo. وعليه يمكن من معرفة أحدهما الحصول على قيمة الآخر من المعادلة كما يلي:
– ومن الملاحظ أن المعادلة السابقة تعبر أيضاً عن قيمة الرقم الهيدروجيني pH للمحلول المائي. والذي يساوي مقلوب لوغاريتم تركيز الهيدروجين في المحلول .
– وعلى ذلك فإن المحاليل المتعادلة تكون قيمة pH فيها مساوية 7. بينما في المحاليل الحامضية تكون القيمة أقل من 7 وأكبر من 7 في المحاليل القاعدية .
– ويبين الجدول التالي ثوابت القاعدية لبعض المركبات العضوية .
المراجع:
كتاب ميكانيكية التفاعلات العضوية ، تأليف/ د.سالم بن شويهان ، د. إبراهيم بن محمود النجار ، د. حمد بن عبدالله اللحيدان ، الرياض – جامعة الملك سعود – الطبعة الثانية 2003م