الأنتيمون Antimony – الخواص الفيزيائية والكيميائية للأنتيمون
محتويات الموضوع
ما هو عنصر الأنتيمون Antimony؟
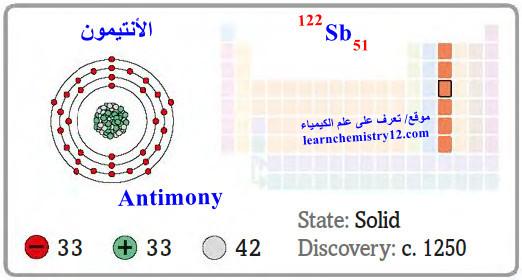
– الأنتيمون antimony هو عنصر من عناصر الجدول الدوري: العدد الذري = 51 ، العدد الكتلي = 122
– الرمز الكيميائي لعنصر الأنتيمون يرمز له بالرمز: 122Sb51
– التوزيع الإلكتروني له: Kr]36 5s2 4d10 5p3]
– الأنتيمون أو الإثمد عنصر من العناصر المتوسطة بين الفلزات واللافلزات، تغلب عليه الصفة المعدنية.
– يوجد في الطبيعة على شكل نظيرين كتلتاهما الذريتان 121 (57.25%) و 123 (%42.75)
– يعرف للأنتيمون عدة أشكال متغايرة، أحد هذه الأشكال هو الشكل الفلزي القصيف المائل إلى الزرقة، ذو البريق المعدني يدعى بالأنتيمون الفضي، أما الآخر فيدعى الأنتيمون الأصفر، وهو غير ثابت إلا تحت درجة حرارة 90 مo
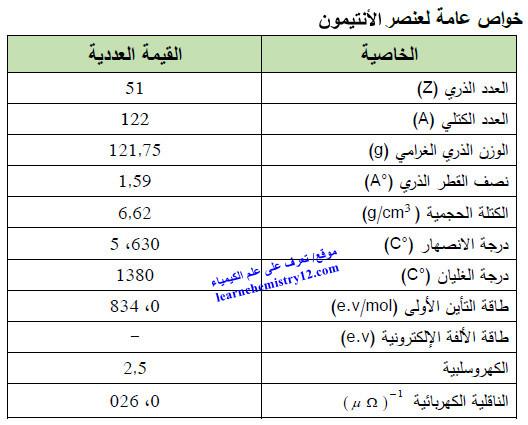
– الجدول التالي يوضح الخواص العامة لعنصر الأنتيمون كما يلي:
اكتشافه ووجوده في الطبيعة Discovery of Antimony
– عرف الأنتيمون منذ القدم، فقد كانت العرب وقبائل آسيا البدوية وخاصة القدماء المصريين تستعمل حجر الإثمد (حجر الكحل) لمداواة الجروح وكحلاً للعيون.
– حجر الكحل هو مركب كبريت الأنتيمون سريع التفتت ولفتاته بريق ولمعان.
– استخرج الرومان الأنتيمون ولم يعرفوا استعماله وفوائده، كما عرفه الصينيون واليابانيون وغيرهم من الشعوب.
– وقد أشار (بريتلو) إلى أن العرب استعملوا الأنتيمون في محاولاتهم لتحضير الذهب.
– ويعتقد أن أصل كلمة أنتيمون عربي (إثمد أو أثمد) اختلف اسمه من بلد إلى آخر، وأخيرا أطلقت عليه تسمية (ستيبيوم Stibium) اليونانية من قبل العالم (بازيل فالانتان) في نهاية القرن الخامس عشر ومن هنا جاء رمزه (Sb)،
– رمز العنصر Sb، يأتي من stibium، الكلمة اللاتينية للكحل، وهو شكل من أشكال مكياج العين.
– حصل الأنتيمون على اسمه من الكلمة اليونانية anti-monos، بمعنى غير وحيد.
– قد يشير هذا إلى حقيقة أن العنصر لم يتم العثور عليه نقيًا في الطبيعة، ولكنه موجود دائمًا مع المعادن الثقيلة، مثل الرصاص.
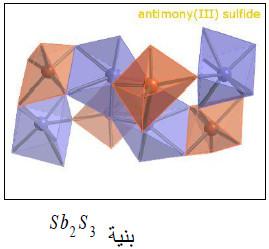
– ولا تتجاوز نسبة الأنتيموان في الطبيعة 5-10 × 5 % وغالباً ما يوجد متحداً بالكبريت Sb2S3، أو يوجد متحداً مع الأكسجين Sb2O3. كما يوجد أيضاً في الجزائر وجنوب تركيا.
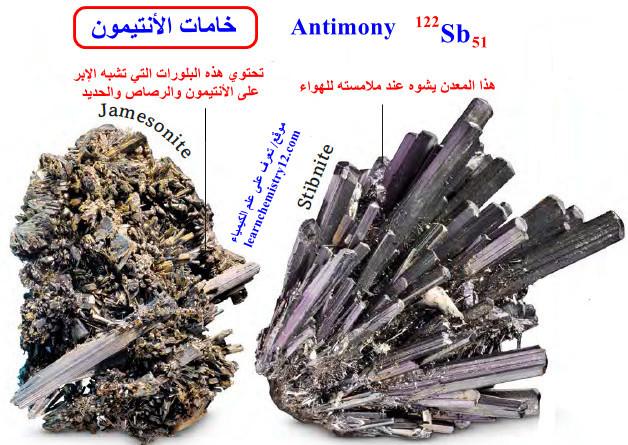
– خام الستبنيت المعدني stibnite هو أكبر مصدر للأنتيمون النقي.
– غالبًا ما يستخدم شكله النقي في صناعة السبائك الصلبة، مثل تلك الموجودة في النوع المعدني الذي تستخدمه بعض الطابعات.
– الكحل المصري القديم كان يصنع من البودرة الستبنيت.
طرق تحضير الأنتيمون Preparation of Antimony
– يتم تحضير الأنتيمون بعدة طرق أهمها حرق السيتيبين stibnite في الهواء فيتحول إلى أكسيده الثلاثي الذي يُختزل بالكربون أو الهيدروجين.
مركبات الأنتيمون Antimony Compounds
(أ) أكاسيد الأنتيمون Antimony Oxides
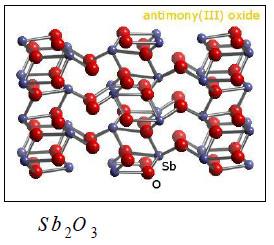
(1) أكسيد الأنتيمون الثلاثي Sb2O3
– يحضر الأنتيمون بعدة طرق أهمها حرق السيتيبين في الهواء فيتحول إلى أكسيده الثلاثي الذي يختزل بالكربون أو الهيدروجين.
(2) أكسيد الأنتيمون الرباعي Sb2O4
– يتكون هذا الأكسيد بتسخين الأكسيد السابق في الهواء أو بأكسدة الأنتيمـون في حمض النيتريك.
– وهو مسحوق لا لون له يتحول بالتسخين إلى اللون الأصفر.
(3) أكسيد الأنتيمون الخماسي Sb2O5
– يعرف باسم أكسيد الأنتيمونيك.
– يتكون بتأثير حمض النيتريك على الأكاسيد السابقة.
– هو مسحوق أصفر اللون يكون عدة هيدرات مع الماء.
– من أمثلتها حمض أورثو أنتيمونيك H3SbO4 وحمض ميثا أنتيمونيك HSbO4
(ب) هاليدات الأنتيمون Antimony Halides
(1) ثالث كلوريد الأنتيمون SbCl3 (زبدة الأنتيمون)
– يحضر بتفاعل غاز الكلور مباشرة مع الفلز أو كبريتيد الأنتيمـون.
– هو عبارة عن مركب متبلور ينصهر عند 73مo ويغلي عند 223 مo.
– يذوب في كمية قليلة من الماء أو في حمض الهيدروكلوريك المخفف.
– يتفاعل مع النشادر مكوناً مركباً صيغته SbCl3.NH3 ولكن هذا المركب ينحل بالتسخين.
(2) خامس كلوريد الأنتيمون SbCl5
– يحضر بتمرير غاز الكلور في ثالث كلوريد الأنتيمـون.
– يوجد في حالة سائلة في درجات الحرارة العادية بالتبريد إلى بلورات تنصهر عند 4 مo
– ينحل خامس كلوريد الأنتيمـون بفعل الحرارة إلى كل من الكلور وثالث كلوريد الأنتيمون كما بالتفاعل التالي:
→ SbCl + Cl Sbcls
(3) رابع كلوريد الأنتيمون SbCl4
– هو متوسط بين الكلوريدين السابقين فلا يعرف في حالته الحرة.
(جـ) كبريتيدات الأنتيمون
(1) ثنائي كبريتيد الأنتيمون SbS2
– يحضر على هيئة راسب أصفر ضارب إلى الحمرة عند معاملة ثيو أنتمونات بأحد الأحماض كما بالتفاعل التالي:
3K3SbS4 + 6HCl → 6KCl + 2SbS2 + 2S2 + H2O
– ينحل ثنائي كبريتيد الأنتيمون بالحرارة إلى ثلاثي كبريتيد الأنتيمـون والكبريت كما بالتفاعل التالي:
SbS2 → Sb2S3 + S
– يذوب في الكبريتات القلوية مكوناً خليطاً من ثيو انتيمونيت وثايو أنتيمونات كما بالتفاعل التالي:
Sb2S4 + 3Na2S → Na3SbS4 + Na3SbS3
(2) ثلاثي كبريتيد الأنتيمون Sb2S3
– يتميز بلونه الأسود وبريقه الفلزي، ينصهر عند 550 مo
– يمكن تحضيره بتمرير غاز كبريتيد الهيدروجين في محلول ثالث كلوريد الأنتيمـون وهو يترسب في هذه الحالة على هيئة راسب برتقالي اللون، لكن يتحول إلى اللون الأسود عند تسخينه إلى 200م
– يذوب ثلاثي كبريتيد الأنتيمـون في القلويات مكوناً ثيو أنتمونيت والميثا أنتمونيت كما بالتفاعلات التالية:
2Sb2S3 + 4KOH → 3KSbS2 + 2H2O + KSbO2
– يذوب في الكبريتات القلوية مكوناً ثيو أنتمونات كما بالمعادلة التالية:
Sb2S3 + 3K2S + S2 → 2K3SbS4
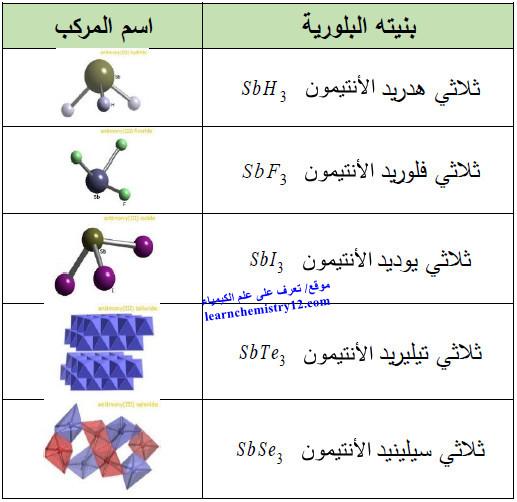
(د) مركبات أخرى
– الجدول التالي يوضح مركبات أخرى لعنصر الأنتيمون كما يلي:
الخواص الكيميائية لعنصر الأنتيمون Chemical properties of Antimony
(1) التفاعل مع الهواء
– عند التسخين، يتفاعل الأنتيمون مع الهواء ليعطي ثالث أكسيد الأنتيمـون مع انطلاق شعلة مزرقة كما بالتفاعل التالي:
4Sb(s) + 3O2(g) → 2Sb2O3(s)
(2) التفاعل مع الماء
– في درجة الحرارة المرتفعة يتفاعل الأنتيمون مع الماء لتشكيل ثالث أكسيد الأنتيمـون كما بالتفاعل التالي:
2Sb(s) + 3H2O(g) → Sb2O3(s) + 3H2(g)
(3) التفاعل مع الهالوجينات
– يتفاعل الأنتيمون في الظروف القياسية مع الفلور، الكلور ، البروم، اليود ليشكل على التوالي: ثالث كلوريد الأنتيمـون، ثالث فلوريد الأنتيمـون، ثالث بروميد الأنتيمـون، ثالث يوديد الأنتيمـون، كما بالتفاعلات التالية:
[أبيض] 2Sb(s) + 3F2(g) → 2SbF3(s)
[أبيض] 2Sb(s) + 3Cl2(g) → 2SbCl3(s)
وفي حالة البروم واليود:
[أبيض] 2Sb(s) + 3Br2(g) → 2SbBr3(s)
[أحمر] 2Sb(s) + 3I2(g) → 2SbI3(s)
(4) التفاعل مع الأحماض
– الأنتيمون ينحل في محاليل ساخنة ومركزة من حمض الكبريتيك أو حمض النيتريك لإعطاء محاليل بها شوارد +Sb3
(5) التفاعل مع الهيدروجين
– يتكون مركب الإستبين SbH3 بتأثير الهيدروجين على سطح الأنتيمـون.
– هو راسب في درجات الحرارة العادية ولا لون له سريع الانحلال بتأثير الحرارة.
– يتحول إلى سائل بالتبريد، ويغلي عند 17 مo
– شديد السمية يحترق في الهواء مكوناً سحب بيضاء من أكاسيد الأنتيمـون.
استخدامات الأنتيمون Uses of Antimony
(1) لابد أن كلا منا قد لمس بيده مركبات الأنتيمـون أكثر من مرة، فالسطح الجانبي من علبة الثقاب مغطى بمزيج يحتوي إلى جانب الفوسفور الأحمر على كبريتيد الأنتيمـون وهو الذي يكسبه اللون البني الداكن.
(2) تستخدم بعض مركبات الأنتيمـون في زيادة صلابة الحديد والصلب، وفي صناعة أنصاف نواقل ممتازة، وأيضا في صناعة الأصبغة سبائك الأنتيمـون والقصدير تستعمل في صناعة حروف الطباعة كي تكتسب مقاومة جيدة للتلف وهذا مهم جدا في الطباعة، لأن الأحرف تستعمل عشرات الآلاف من المرات.
(3) سبائك الأنتيمون والرصاص تدخل في صناعة الأجهزة والأدوات الكيميائية وإنتاج الأنابيب التي تنقل الأحماض القلوية وغيرها من السوائل العدوانية، كما تصنع منها الأغلفة التي تلف الأسلاك الكهربائية وأسلاك البرق والهاتف.
(4) كما يضاف أكسيد الأنتيمـون إلى الأقمشة (ستائر المسارح والمؤسسات العامة وقماش الخيم) لجعلها تصمد أمام النيران.
(5) تستخدم مركبات الأنتيمـون أيضاً في حالات التهاب الرئة والتهاب الكبد، كما تفيد في مكافحة أمراض عديدة خاصة في المدن التي تكون فيها درجة الحرارة مرتفعة جداً.
(6) علاوة على ذلك تستخدم بعض المطابع هذه الحروف المعدنية، وهي مصنوعة من سبيكة من الأنتيمون والقصدير.
(7) كما يستخدم في صناعة الكحل وهو مكياج للعين.
المراجع: دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر.