الأستاتين Astatine – الخواص الفيزيائية والكيميائية
محتويات الموضوع
ما هو عنصر الأستاتين Astatine؟
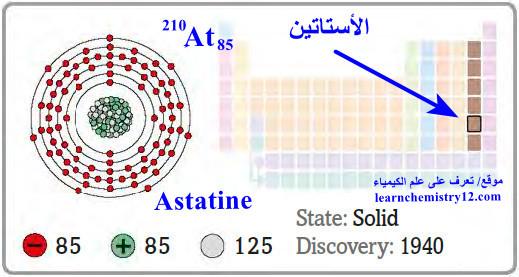
– الأستاتين Astatine هو عنصر من عناصر الجدول الدوري: العدد الذري = 85 ، العدد الكتلي = 210
– الرمز الكيميائي لعنصر الأستاتين يرمز له بالرمز: 210At85
– التوزيع الإلكتروني له: Xe]54 6s2 4f14 5d10 6p5]
– الأستاتين هو عنصر مشع.
– يعد أثقل عناصر مجموعة الهالوجينات التي تنتمي إليه.
– عنصر غير مستقر وتتفكك كل نظائره الثلاثين إشعاعياً.
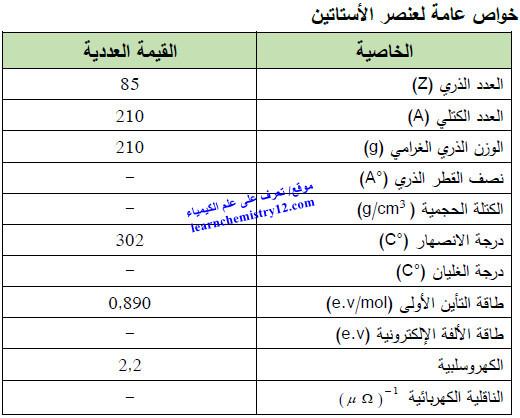
– الجدول التالي يوضح الخواص العامة لعنصر الأستاتين كما يلي:
اكتشافه ووجوده في الطبيعة Discovery of Astatine
– تم تحضير الأستاتين لأول مرة عام 1940م.
– كان الفيزيائي الإيطالي إميليو سيجري في مدينة بيركلي بكاليفورنيا بالولايات المتحدة الأمريكية من أوائل العلماء الذين عزلوا عينة من الاستاتين النقي.
– لقد كان قادرًا على القيام بذلك باستخدام مسرع الجسيمات: وهي آلة تقوم بتحطيم الذرات معًا ومن ثم دراسة النتائج.
– الأستاتين هو أندر العناصر الموجودة في الطبيعة، أي أستاتين كان موجودًا عند تكوين الأرض قد اختفى منذ فترة طويلة
– رغم وجود كمية قليلة من العنصر في اليورانيوم الخام فإن كل الاستاتين تقريبا يحضر صناعياً.
– كما يتشكل هذا العنصر المشع نفسه بطريقة مماثلة عندما تتفكك ذرات عنصر أثقل يسمى الفرنسيوم.
– تم العثور على كميات صغيرة من هذا العنصر النادر في خامات اليورانيوم، مثل اليورانينيت Uraninite، حيث تتفكك ذرات عنصر الفرنسيوم غير المستقرة داخل هذا المعدن، لتشكل ذرات الاستاتين.
– ذرات الأستاتين غير مستقرة، وعادة ما تتحلل بعد بضع ساعات فقط، إلى ذرات عناصر أخف، مثل البزموث.
تحضير الأستاتين Preparation of Astatine
– أنتج الأستاتين داخل سليكلوترون بقذف البزموث بجسيمات ألفا ذات طاقة عالية.
– النظائر الأربعة الموجودة بشكل طبيعي (أستاتين-215، -217، -218، -219) يتم إنتاجها بشكل مستمر نتيجة لتحلل خامات الثوريوم واليورانيوم المشعة ، وكميات ضئيلة من النبتونيوم -237.
الخواص الكيميائية لعنصر الأستاتين Chemical properties of Astatine
(1) مركبات الأستاتين Astatine Compounds
(أ) هيدريد الأستاتين HAt
– يعرف أيضاً بهيدروجين الاستاتين.
– كما يسلك هذا المركب سلوك مشابه جداً لهاليدات الهيدروجين.
– وبما أن ذراته لها كهروسالبية متقاربة فهذا يؤدي إلى سهولة تفككه والخضوع للتفاعلات الآتية كما يلي:
2HAt → H2 + At2
(ب) أحادي بروميد الأستاتين AtBr
– يتم إنتاجه عن طريق تفاعل البروم مع الاستاتين في محلول مائي من اليود كما بالتفاعل التالي:
At2 + 2IBr → 2AtBt + I2
(جـ) أحادي يوديد الأستاتين AtI
– يتم إنتاجه عن طريق تفاعل مباشر بين الاستاتين واليود كما بالتفاعل التالي:
At2 + I2 → 2AtI
(د) أحادي كلوريد الأستاتين AtCl
– يتم إنتاجها من قبل مجموعة من فوق الكرومات والكلور ولكن إلى حد الآن لم يتم الحصول على الـ AtCl كمركب نقي.
(2) التفاعل مع الهالوجينات
– الأستاتين يتفاعل مع البروم واليود لتشكيل (AtBr (inter halogene و AtIعلى التوالي، وكل منها تذوب في رابع كلوريد الكربون CCl4 كما بالتفاعلات الآتية:
At2 + Br2 → 2AtBr
At2 + I2 → 2AtI
(2) التفاعل مع الأحماض
– الأستاتين يذوب في حمض النتريك المخفف HNO3 أو حمض الهيدروكلوريك المخفف HCl
استخدامات الأستاتين
– يستخدم النظير الاستاتين – 211 فى الطب النووي ويجب استخدامه بسرعة لأنه يتحلل بنصف عمر يبلغ 7.2 ساعة.
– الفرق الطبي الرئيسي بين الأستاتين-211 واليود-131 (أحد نظائر اليود المشعة المستخدمة أيضًا في الطب) هو أن اليود-131 يصدر جزيئات بيتا عالية الطاقة، بينما الاستاتين لا يصدرها.
تأثير العنصر على الانسان
– إن الأستاتين والمعروفة بعقاقير تخفيض الكولسترول تشكل خطر على صحة الإنسان:
(1) تعمل على تقليل مستويات الطاقة عند الأشخاص الذين يتناولونه وذلك لما لها من تأثير سلبي على أنسجة العضلات (فهي تعمل على إفشال العضلات).
(2) كما تحدث الإصابة بالسكتة الدماغية في حالة حدوث نزيف عميق بالمخ الذي يحدث عادة من ارتفاع ضغط الدم لفترات طويلة للأشخاص الذين يتناولونها.
(3) بالرغم من هذه المخاطر فإن له إيجابيات على صحة الإنسان فهو يعمل على تقليل مخاطر الإصابة بسرطان البروستاتا.
– المراجع:
- دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان. أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر.
- The Periodic Table Book – A Visual Encyclopedia of Elements written by Tom Jackson. – consultant Jack Challoner – Great Britain 2017




ما شاء الله استمر بالابداع