الكيمياء العامة
الكيمياء العامة تُعد أساس فروع الكيمياء، تدرس المادة وخواصها وتغيراتها. تشمل الذرات، الجزيئات، التفاعلات، والمعادلات. تساعد في فهم الظواهر الطبيعية وتطبيقات العلوم في الحياة اليومية.
-
القوى النسبية للأحماض والقواعد Relative Strength of Acids and Bases
القوى النسبية للأحماض والقواعد Relative Strength of Acids and Bases ** قوة أي حمض HA في محلول مائي هو مقياس لقدرته…
أكمل القراءة » -
تحميل كتاب/ مفاهيم كيميائية وتجارب عملية مبسطة
– إستكمالأ لقائمة الكتب الكيميائية الرائعة والمختلفة الذي يقوم موقعنا بتوفيرها للأعضاء الكرام ، نقدم لكم في هذا الموضوع كتاب…
أكمل القراءة » -
قانون دالتون للضغوط الجزئية Dalton’s Law of Partial Pressures
قانون دالتون للضغوط الجزئية كان من الاھتمامات الرئیسية للعالم دالتون دراسة الظروف المناخیة والجویة . ولقد احتفظ لمدة ٥٧…
أكمل القراءة » -
الشكل الهندسي للجزيء والزاوية بين الروابط
– بعد أن تمكنا من معرفة بنية لويس لأي مركب وفقاً للقواعد التي ذكرناها في الموضوع السابق (بنية لويس –…
أكمل القراءة » -
أنواع تفاعلات الأكسدة والأختزال Redox Reactions
أنواع تفاعلات الأكسدة والأختزال يمكن تقسيم تفاعلات الأكسدة والأختزال كما يلي: (1) تفاعلات الاتحاد المباشر Combination reactions (2) تفاعلات الانحلال…
أكمل القراءة » -
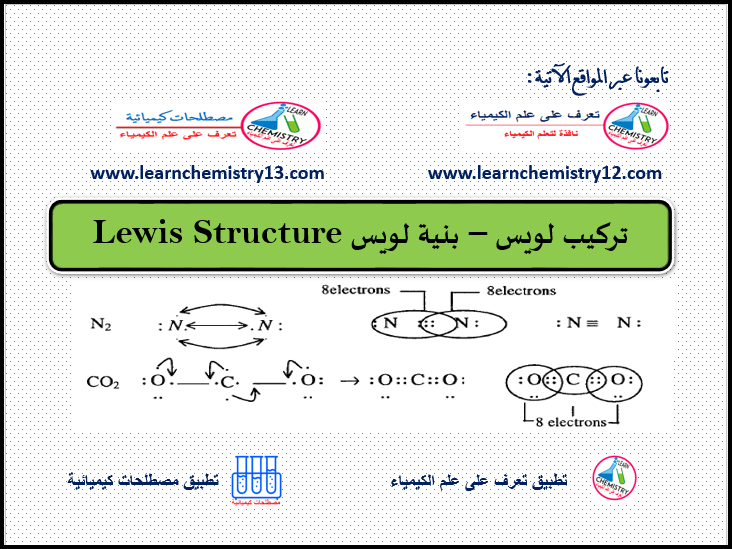
تركيب لويس – بنية لويس Lewis Structure
من هو لويس؟ جيلبرت نيوتن لويس Gilbert Newton Lewis هو عالم كيمياء فيزيائية أمريكي الجنسية ولد في 23/10/1875 ، بحث…
أكمل القراءة » -
كتابة المعادلة الكيميائية Chemical Equation وكيفية وزنها
المعادلة الكيميائية Chemical Equation المعادلة الكيميائية هي صورة توضح المواد الداخلة فى التفاعل الكيميائي والمواد الناتجة من هذا التفاعل والتغير…
أكمل القراءة » -
مسائل محلولة على الحرارة Solved problems on Heat
قبل البدء فى حل هذة المسائل يلزمك مراجعة المفاهيم والتعاريف والقوانين الأساسية فى الحرارة ولعمل لذلك اقرأ هذا الموضوع: تعريفات…
أكمل القراءة » -
تسمية المركبات غير العضوية Nomenclature of inorganic compounds
الصيغة الكيميائية Chemical formula تعبر الصيغة الكيميائية عن العديد من صفات المركب، فهي تختصر الكثير من المعلومات بصيغة رمزية وهي…
أكمل القراءة » -
الحرارة – تعريفات هامة متعلقة الحرارة
فى هذا الموضوع سيتم مناقشة بعض تعريفات الحرارة والمفاهيم الأساسية المتعلقة بالحرارة (1) درجة الحرارة Temperature – درجة الحرارة هى…
أكمل القراءة » -
مسائل محلولة على رتبة التفاعل Solved Problems On Reaction Order
يمكنك قراءة هذة الموضوعات قبل البدء فى حل المسائل حتى تكون على دراية كاملة بالقوانين المستخدمة فى حل هذة المسائل…
أكمل القراءة » -
طرق تعيين رتبة التفاعل Determination of Reaction Order
رتبة التفاعل Order of Reaction ** يعبر عن التغير في سرعة التفاعل مع التغير في تركيز المواد المتفاعلة بواسطة قانون فعل الكتلة.…
أكمل القراءة » -
القانون العام للغازات المثالية + مسائل محلولة General Ideal Gas Law
استنتاج القانون العام للغازات المثالية 1) أخبرنا قانون شارل ومبدأ أفوجادرو بأن الحجم لغاز يتناسب طردياً مع : أ) درجة…
أكمل القراءة » -
معادلة القانون الموحد للغازات + مسائل محلولة The Combined Gas Law Equation
معادلة القانون الموحد للغازاتThe Combined Gas Law Equation حالة الغاز یمكن تحدیدھا بدلالة كل من كمیته (n) وحجمه (V) وضغطه…
أكمل القراءة » -
قانون جاي لوساك للغازات + مسائل محلولة (Gay-Lussac’s Law (P-T relationship
إذا سخن حجم معین من غاز في إناء مغلق ثابت الحجم(صلب مثلاً) فإن الحجم في هذه الحالة لا یتمدد،…
أكمل القراءة » -
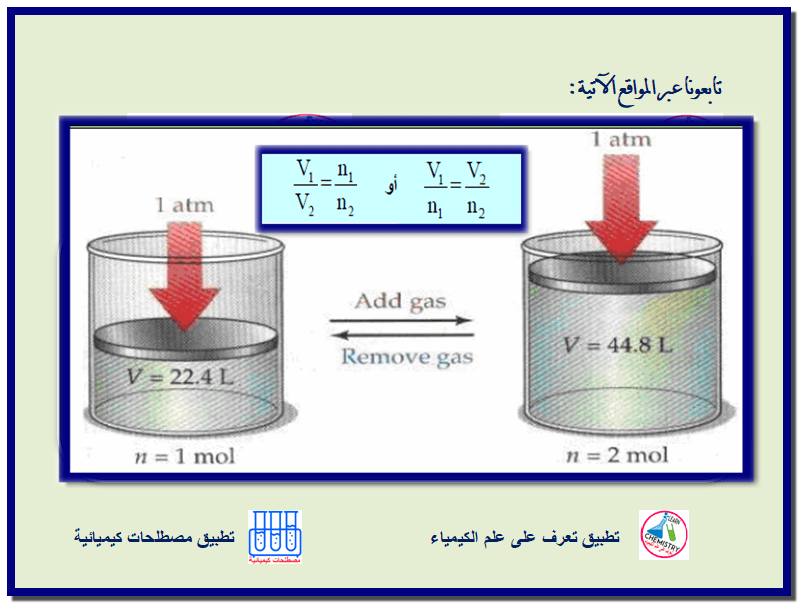
قانون أفوجادرو وحساب الحجم المولاري Avogadro’s Law and the Molar Volume
نلاحظ أنه كلما أضفنا مزیداً من الغاز للبالونات أو لإطار سیارة فإنه تزداد أحجامھا، مما یدعونا للاستنتاج أن العوامل…
أكمل القراءة » -
قانون جاي- لوساك للحجوم المتحدة Gay-Lussac’s Law of Combining Volumes
قانون جاي- لوساك للحجوم المتحدة ** تستخدم المعادلة الكیمیائیة التي تدل على تفاعل أو إنتاج مادتین أو أكثر في الحالة…
أكمل القراءة » -
مسائل محلولة على قانون شارل للغازات Solved problems on Charle’s Law
نص قانون شارل أن علاقة حجم الغاز ودرجة الحرارة التى تم دراستها من قبل العالم الفرنسي تشارلز 1787م، وطورها…
أكمل القراءة » -
قانون شارل للغازات Charle’s Law من الاكتشاف حتى الصيغة النهائية
بداية اكتشاف قانون شارل Charle’s Law – مضى أكثر من قرن زمني على اكتشاف العلاقة المناظرة لقانون بویل (قانون شارل).…
أكمل القراءة » -
الهيدروجين Hydrogen – الخواص الكيميائية والفيزيائية له
الخواص الفيزيائية للهيدروجين Physical properties of hydrogen – للهيدروجين صفات فيزيائية وكيميائية استثنائية وفريدة في حد ذاتها. ويعزي ذلك…
أكمل القراءة »