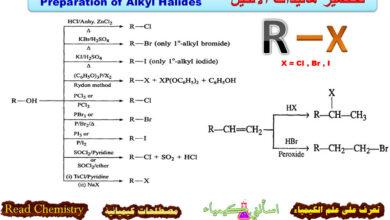
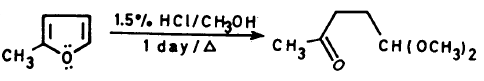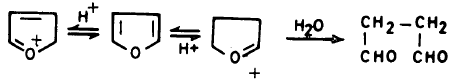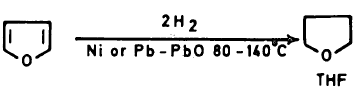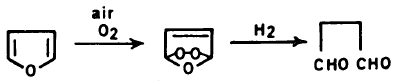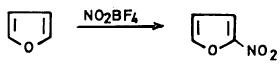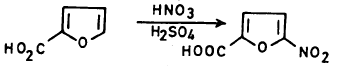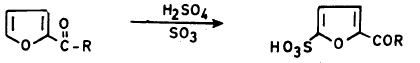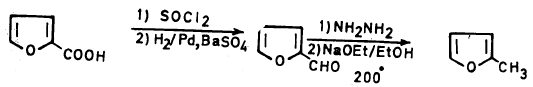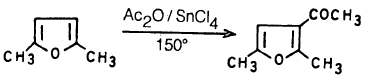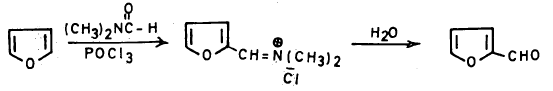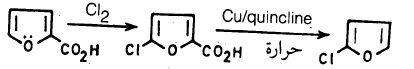تفاعلات الفيوران Furan reactions
تم مناقشة تحضير الفيوران وخواصه الفيزيائية في الموضوعات السابقة وفي هذا الموضوع سيتم مناقشة تفاعلات الفيوران بالتفصيل.
ما هو الفيوران Furan؟
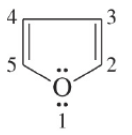
– الفيوران مركب خماسي الحلقة غير متجانس يحتوي على ذرة أكسجين واحدة.
– يحدد مكان السلسة الجانبية أو المجاميع الفعالة على الحلقة بأعداد ويجب أن تأخذ ذرة الأكسجين رقم (1).
– وهو مركب عديم اللون ولكنه يتغير إذا تعرض للهواء الجوي.
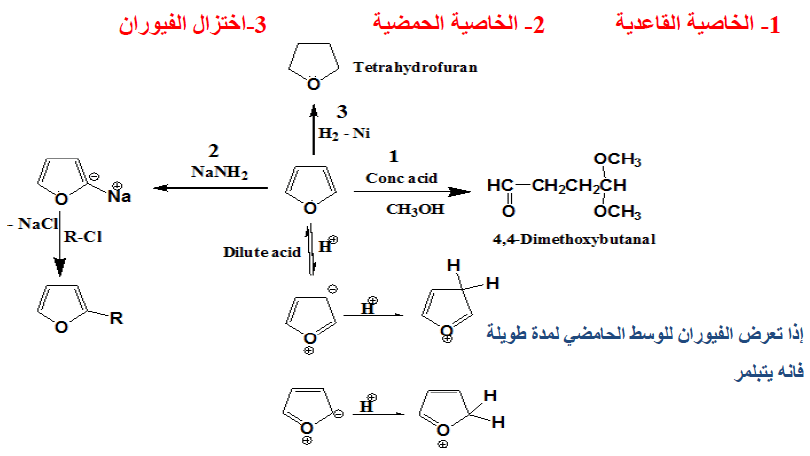
قاعدية الفيوران Basicity of Furan (الخواص القاعدية للفيوران)
– تفتح حلقة الفيوران بسهولة بواسطة الحموض وهذا يشبه إلى حد ما التحلل المائي في وسط حمضي للإينول إيثر.
– كذلك فإن الإضافة من نوع 2,5Addition إلى الرابطة المضاعفة في الفيوران تحدث بكل سهولة. مما ينتج عنه مشتق ثنائي هيدروفيوران (Dihydrofuran).
– عملية استبدال ذرات الهيدروجين في الفيوران في أغلب الأحـوال تفضـل الموضعين (5) , (2) وعملية الاستبدال في هذه الحالة تتم عن طريق الإضافة لتعطي مركب ثنائي الهيدرو ( Dihydro compound) يتبع ذلك عملية حذف أو استبدال مباشر كما هو الحال في البنزين .
– وحيث إن الفيوران غير ثابت في الوسط الحمضي نظراً لتبلمره أو انفتاح حلقته. فعلى سبيل المثال نجد أنه مع حمض الكبريتيك أو حموض لويس القوية تنفتح حلقة الفيوران إلا أنه يتفاعل عند درجة حرارة الغرفة مع حمض كلوريد الهيدروجين ويعطي إضافة على موضعي (2) ، أو (3) كما هو موضح في المعادلة التالية:
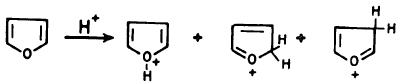
– أما عند تسخينه في الوسط الحمضي المخفف فإن هذا يؤدي إلى فتح الحلقة.
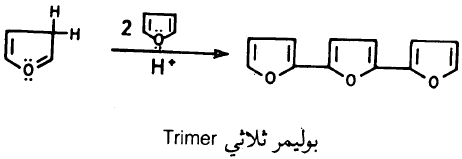
– وإذا تعرض الفيوران للوسط الحمضي لمدة طويلة فإنه يتبلمر معطيا ناتج بلمرة ثنائي أو – ثلاثي.
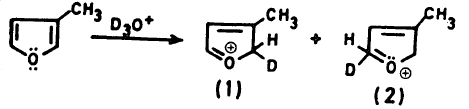
وعلى العموم فإن وجود مجاميع ألكيلية على حلقة الفيوران له أثر على كل من توجيه وتثبيت التفاعل. ومن الأمثلة على ذلك نجد أن ناتج (1) أكثر ثباتاً من ناتج (2) في المعادلة التالية:
حامضية الفيوران Acidity of Furan (الخواص الحامضية للفيوران)
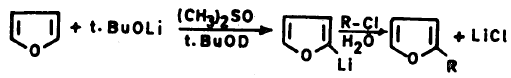
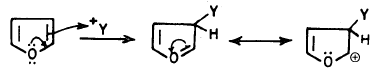
– الفيوران ومشتقـاتـه الألكيلية لا تتفاعل مع الكواشف النيكلوفيلية عن طريق الإضافة أو الاستبدال. ولكن بدلاً من ذلك يمكن للقواعد القوية أن تنزع بروتوناً من موضع (2) في الفيوران ويتكون مركب عضو معدني.
– ومن أهم القواعد التي تستطيع أن تقوم بذلك كل من ليثيوم البيتوكسيد الثالثي t. Butoli ألومنيوم هيدريد الليثيوم LiAlH4 . وعلى العموم فإن ناتج هذه التفاعلات يمكن أن يستخدم في تحضير الكثير من مشتقات الفيوران.
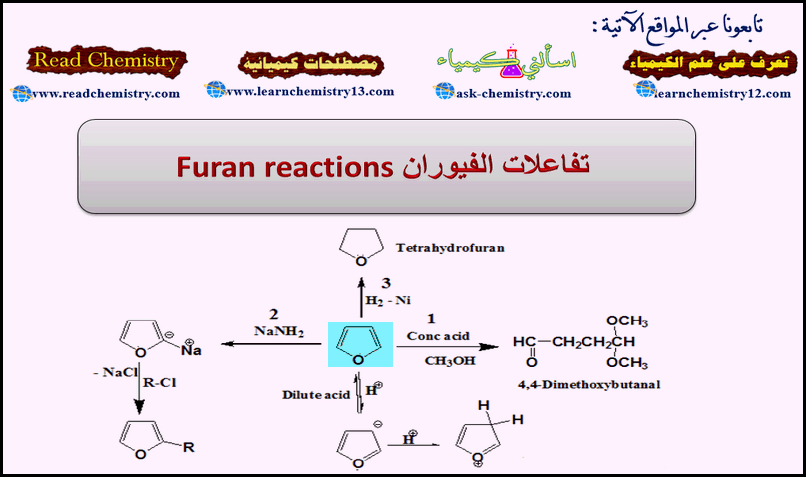
تفاعلات الفيوران Furan Reactions
تقسم تفاعلات الفيوران إلى:
(1) تفاعلات الفيوران كإيثر.
(2) تفاعلات الإضافة.
تفاعـل دييلز ـ الـدرDiels-Alder reaction – الأكسدة – الاختزال – تفاعلات إضافة أخرى
(3) تفاعلات الاستبدال الإلكتروفيلية.
النيترة – السلفنة – الألكلة – الأسيلة – الهلجنة
أولاً/ تفاعل الفيوران كإيثر
– کما سبق وأن أشرنا فإن مركبات الإيثر التي تحتوي على رابطة ثنائية في وضع متبادل مع زوج الإلكترونات الحرة على الأكسجين والتي تسمى إينول إيثر ( Enolether) يمكن أن تتحلل في الوسط الحمضي المخفف بكـل سـهـولـة إلى مركب الكربونيل المطابق.
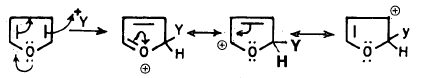
– إلا أن الفيوران لا يتحلل بتلك السهولة وذلك لأن بروتون الحمض في العادة يهاجم إلكترونات الأكسجين الحرة، وهي في حالة الفيوران مشتركة في تكوين السحابة الإلكترونية لحلقة الفيوران.
– فإذا هوجمت بواسطة بروتون الحمض فإن هذا يؤدي إلى جذب تلك الإلكترونات وتقليل طاقة الرنين. ويحول حلقة الفيوران العطرية إلى كاتيون أقل استقراراً. مما يؤدي إلى انفتاح حلقة الفيوران كا يتبين ذلك من المعادلة التالية:
ثانياً/ تفاعلات الإضافة للفيوران
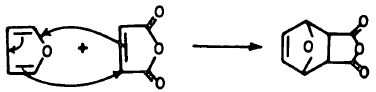
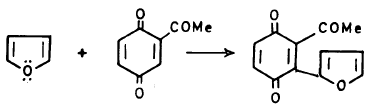
(1) تفاعـل دييلز ـ الـدرDiels-Alder reaction
– يتفاعل الفيوران كمركب عطري إلا أنه في بعض الأحيان يتصرف وكأنه 3,1 ـ دايين (Diene1.3)
– ومن المعروف أن الفيوران أقل عطرية من الثيوفين والبيرول وهو الوحيد من بينها الذي يستطيع أن يقوم بتفاعل ديلز – الدر بكل سهولة.
(2) اختزال الفيوران Reduction of Furan
– يمكن اختزال الفيوران بواسطة الهيدروجين في وجود عامل مساعد مثل النيكل المجفف أو الرصاص Pb-PbO إلى النيتراهيدروفيوران.
– ومن الجدير بالذكر أن هناك مركبين محتملين للفيورانات المختزلة جزئياً هما 3٫2- ثنائي هیدروفیوران و2, 5- ثنائي هيدروفيوران.
– أمـا النيتراهيدروفيوران فهـو ذو أهمية كبيرة كمذيب لكثير من التفاعلات. ويمكن تحضيره كما يلي:
(3) أكسدة الفيوران Oxidation of Furan
– الفيوران مركب غير ثابت في وجـود الهـواء والأكسجين. إلا أنه يمكن أن يضاف إليه بعض المواد مثل الهيدروكينون بكميات قليلة لتعمل على ثباته.
– وغالباً فإن الأكسدة الجوية تؤدي إلى تكوين البيروكسيد عن طريق الإضافة من نوع ( Addition-2,5). وهذا يمكن أن يتبلمر بطريقة الشقوق الحرة. وفي حالة هدرجة البيروكسيد الناتج نحصل على سكسينالدهيد.
– يتأكسد الفيوران بصورة كاملة بواسطة برمنجانات البوتاسيوم KMnO4
– يمكن أكسدة الفيوران بواسطة البروم في الكحول الميثيلي والحصول على خليط من سز وترانس -2 و5 ثنائي هيدرو، و2 و5 ثنائي ميثوكسي فيوران، وهذا يتحلل في الوسط الحمضي إلى ثنائي الدهيد الماليك.
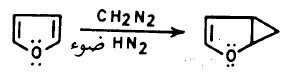
(4) تفاعلات إضافة أخرى
– هناك تفاعلات إضافة كثيرة يستطيع الفيوران أن يقوم بها مثل تفاعله مع الـكـاربـين والنيترين.
كما أنه يستطيع أن يتفاعل كنيكلوفيل تحت ظروف معينة. بالإضافة إلى تفاعلات الإضافة التي يقوم بها بمساعدة الضوء Photolysis.
(أ) تفاعل الفيوران مع النترين
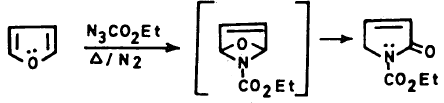
(ب) تفاعل الفيوران مع الكاربين
(جـ) عندما يتفاعل كنكلوفيل
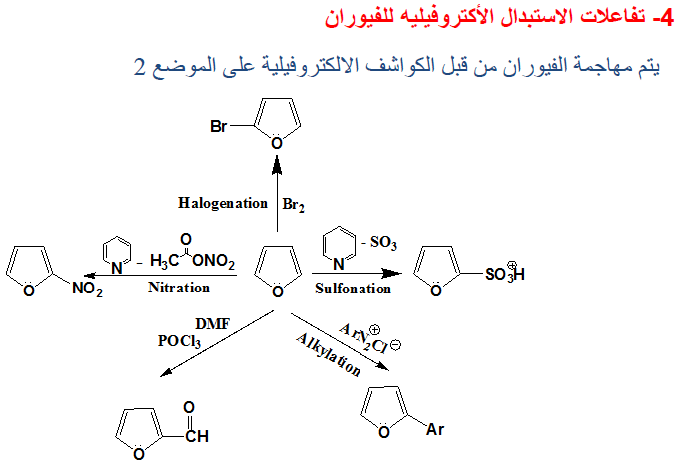
ثالثاً/ تفاعلات الاستبدال الإلكتروفيلية Electrophilic substitution reactions
– عند شرح الخواص الفيزيائية للفيوران لوحظ من الصيغ التأرجحية أن الكثافة الإلكترونية قد تمركزت بصورة رئيسة عند موضعي 2ـ و5- وأقل ما يمكن عند موضعي 3- و4ـ وهذا يعني أن تفاعلات الاستبدال الإلكتروفيلية سوف تفضل موضعي 2- و5-
– وبالإضافة إلى تمركز الشحنة السالبة عند موضعي 2ـ و5- فإن المركب المتوسط الناتج عن عملية الاستبدال الإلكتروفيلية على هذين الموضعين توجد له ثلاث صيغ تأرجحية مما يزيد من ثبـاتـه بالمقارنة مع صيغتين من التراكيب التأرجحية الناتجة عن عملية الاستبدال الإلكتروفيلية عند موضعي 3- و4- کما تبين ذلك الصيغ التالية:
عملية الاستبدال الإلكتروفيلية في موضع (2) أو (5)
عملية الاستبدال الإلكتروفيلية في موضع (3) أو (4)
ومن أهم تفاعلات الاستبدال الإلكتروفيلية التفاعلات الآتية:
(1) النيترة Nitration
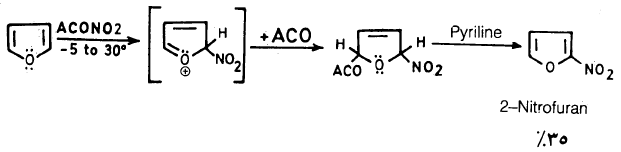
حيث إن الفيوران يتبلمـر أو يتكسر إذا تعـد للحموض المركزة لمدة طويلة فإن هذا يحد من نيترة الفيوران تحت ظروف مشابهة لتلك المستخدمة عند نيترة البنزين.
– ولذلك فإن عملية النيترة يجب أن تتم عند درجات حرارة منخفضة وباستخدام نترات الاستيل (Acetyl nitrate) ، والتي تنتج من خلط حمض النتريك مع حمض الخل اللامائي، وعلى العموم فإن النيترة بهذه الطريقة تتم عن طريق إضافة من نوع Addition-1,4 تتلوها عملية حذف في وجود قاعدة مثل البريدين معطية 2- نتروفيوران
– وعلى العموم فإن عملية النيترة تتم عند موضعي2 و5 وفي حالة وجود مجموعات بديلة في هذين الموضعين فإن عملية النيترة تتم عند مواضع (3).
– ومن الملاحظ أنه عند استخدام نيترونيوم رابع فلوريد البورون ( Nitronium tetraflouroborate) في عملية النيترة فإنها تتم بصورة مباشرة بدون المرور على مركب وسطي.
– ومما يجدر ذكره هنا أنه عند وجود مجموعات ساحبة للإلكترونات مثل مجموعة النيترو والكـربـونيل وغيرهمـا فإن هذا يساعد على استقرار الحلقة وزيادة الخاصية الأروماتية وبالتالي يسمح بعملية النيترة المباشرة كما هو مبين بالمعادلة التالية:
(2) السلفنـة Sulphonation
– كما هو الحال في عملية النيترة لا تتم عملية السلفنـة في الفيوران ومشتقاته الألكيلية في وجود الحموض المركزة وذلك لتكسره أو تبلمـره.
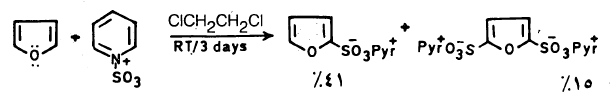
– ولـذلـك نستخدم ظروفاً مناسبة مثل استخدام معقد ثالث أكسيد الكبريت والبيريدين حيث يعطي حمض فيوران ۲ـ سلفونيك بصورة رئيسة وكمية قليلة من حمض فيوران ٢- و5- ثنائي سلفونيك.
حيث = Pyr + أيون البريدين .
أما في حالة وجود مجاميع ساحبة للإلكترونات على حلقة الفيوران فإنه يمكن سلفنتها مباشرة أي بطريقة سلفنة البنزين.
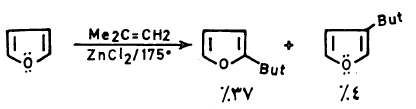
(3) الألكلـة Alkylation
– عند ألكلة الفيوران بواسطة هاليدات الألكيل في وجود عامل مساعد من حموض لويس مثل ثالث كلوريد الألمنيوم وغيره أي ألكلة فريدل ـ كرافتز ـ فإن ناتج التفاعل عبارة عن مواد متبلمرة.
– كما أن عملية الألكلة تتم على أكثر من موضع وهذا يجعل عملية الألكلة المباشرة للفيوران غير مفيدة.
– إلا أن عملية الألكلة المباشرة يمكن أن تتم تحت ظروف خاصة ونادرة يمكن أن نذكر منها المثال التالي:
– وهناك عدة أسباب يمكن أن يعزى إليها ذلك وهي أن حموض لويس تساعد على بلمرة الفيوران أو فتح حلقته. بالإضافة إلى أن المشتقات الألكيلية للفيوران سهلة التبلمر بالمقارنة مع الفيوران نفسه وذلك أنها تساعد على زيادة الكثافة الإلكترونية على الحلقة ولذلك فإن مشتقات الفيوران الألكيلية يتم تحضيرها بطرق غير مباشرة.
– فعلى سبيل المثال المعادلة السابقة تمثل تحضير ٢ـ مثيل فيوران عن طريق تحويل حمض ۲- فيوريك (Furic acid-2) بواسطة كلوريد الثيونيل إلى كلوريد الحمض وهذا يختزل بواسطة الهيدروجين وعامل مساعد مثل Pd/BaSO4 إلى الألدهيد المطابق والذي بدوره يختزل بطريقة وولف ـ كشنر إلى المركب المطلوب وهو ٢ ـ مثيل فيوران.
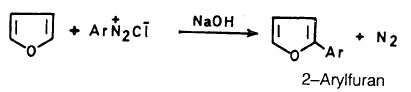
– ومن ناحية أخرى يمكن إدخال مجموعة الأريل على حلقة الفيوران وذلك وفق التفاعل التالي حيث نحصل على ٢- أريل فيوران.
(4) الأسيلـة Acylation
– عندما تتوافر الظروف المناسبة فإن أسيلة الفيوران تتم بكل سهولة حيث يمكن استخدام كلوريدات الحموض أو الحموض اللامائية في وجود عوامل مساعدة مثل حمض أورثوفوسفوريك أو عوامل فريدل ـ كرافتس .
– وعلى الـعـمـوم فإنـه يـمـكـن أسـلة الـفـيـوران نفسه بواسطة Ac2O – SnCl4 أو AcOSO2C6H4-PCH3 عند درجة حرارة الغرفة حيث نحصل على 2- استيل فيوران ويمكن توضيح ذلك بالمعادلات التالية:
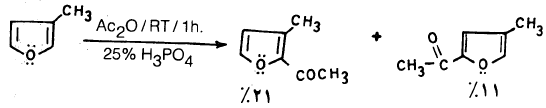
– ويجب أن يضـاف الحمض اللامائي أو كلوريد الحمض إلى العامل المساعد أولاً ثم يضاف بعد ذلك الفيوران.
– وعندما يكون كل من موضع 2ـ و5- مشغولاً فإن الأسيلة تتم عند موضع 3-
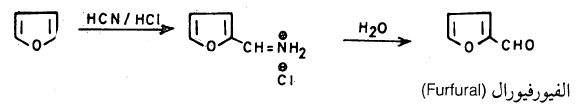
ومن التفاعلات الأخرى التي يقوم بها الفيوران تفاعل جايترمان حيث يستطيع الفيوران أن يتفاعل مع سيانيد الهيدروجين في وجود كلوريد الهيدروجين بدون الحاجة إلى عامل مساعد حيث نحصل على الفيور فيورال إلا أن نسبة الناتج منخفضة
ويمكن رفع هذه النسبة بواسـطة تفـاعـل فايلز مایر (Vilsmeier reaction) وهـو تـفـاعـل الفيوران معN1N – ثنائي مثيل الفورماميد وأوكسي كلوريد الفسفور كما تبين ذلك المعادلة التالية:
(5) الهلجنة Halogenation
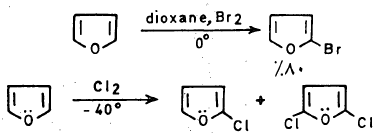
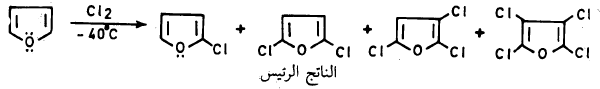
– يتفاعل الفيوران مع الهالوجينات بصورة قوية عند درجة حرارة الغرفة فعند تفاعله مع الكلور والبروم فإن ذلك يؤدي إلى نواتج عديدة الهـالـوجـين.
– ولإدخال ذرة كلور أو بروم واحدة على حلقة الفيوران يجب استخدام ظروف هادئة (Mild conditions) مثل درجة حرارة منخفضة.
– كما أن استخدام الحمض اللامائي يساعد على إزالة هاليد الهيدروجين الناتج من عملية الاستبدال عنـد تفاعل الهالوجين مع الفيوران مما يمنع عملية البلمرة أو التفكك ويجعل عملية الاستبدال تتم بكل سهولة.
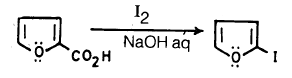
– أما اليود فإنه لا يتفاعل مع الفيوران إلا بصورة غير مباشرة حيث يمكن إدخال اليود وذلك بأن يحل محل مجموعة كربوكسيلية على حلقة الفيوران في وسط قاعدي كما يلي:
– أما كلورة الفيوران في الظروف العادية فتعطي خليطاً من كلوريدات الفيوران يكون فيها ٢ و5 ثنائي كلوروفيوران هو الناتج الرئيسي. وعند استخدام زيادة من الكلور نحصل على النواتج التالية:
– ومن الطرق غير المباشرة في تحضير مشتقات الفيوران الهالوجينية هلجنة حلقة الفيوران التي تحمل مجاميع ساحبة للإلكترونات. والتي يمكن التخلص منها بعد إتمام الهلجنة مثل مجموعة الكربوكسيل.
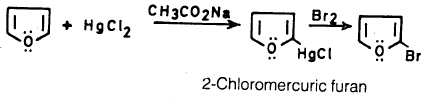
ومن الطرق الأخرى استخدام كلوريد الزئبق. حيث يتفاعل مع الفيوران في محلول خلات الصوديوم والناتج يتفاعل مع الهالوجين حيث نحصل على عملية استبدال.
ملخص تفاعلات الفيوران
المراجع:
- كتاب المركبات الحلقية غير المتجانسة والحيوية للدكتور حمد بن عبدالله اللحيدان والدكتور محمد بن إبراهيم الحسن والدكتور سالم سليم الذياب – الطبعة الثانية – جامعة الملك سعود – المملكة العربية السعودية
- محاضرات 341 كيم كيمياء المركبات الحلقية غير المتجانسة Chemistry of Heterocyclic Compounds للدكتور عبدالله بن محمد الماجد – جامعة الملك سعود – السعودية
- كتاب الكيمياء العضوية للمؤلف د. حسن محمد الحازمي / الجزء الثاني