الروثينيوم Ruthenium – الخواص الفيزيائية والكيميائية له
محتويات الموضوع
ما هو عنصر الروثينيوم Ruthenium؟
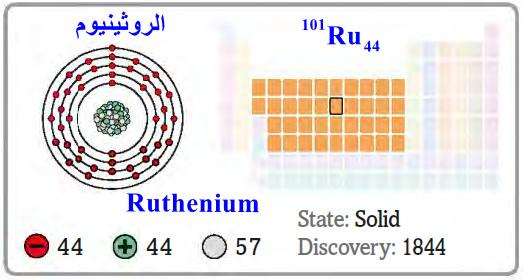
– الروثينيوم Ruthenium هو عنصر من عناصر الجدول الدوري: العدد الذري = 44 ، العدد الكتلي = 101
– الرمز الكيميائي لعنصر الروثينيوم يرمز له بالرمز: 101Ru44
– التوزيع الإلكتروني له: Kr]36 5s1, 4d7]
– الروثينيوم Ruthenium فلز أبيض قاس متعدد التكافؤ.
– ينتمي إلى مجموعة البلاتين.
– وهو كمعظم العناصر خامل كيميائياً اتجاه معظم المواد.
– يتوفر عادة في الطبيعة كمكون بسيط من خامات البلاتين وإنتاجه سنوياً لا يتجاوز الـ 12طن في جميع أنحاء العالم.
– بالإضافة إلى ذلك فأنه يستخدم في الوصلات الكهربائية المقاومة للاهتزاز وفي إنتاج المقاومات ذات الغشاء السميك.
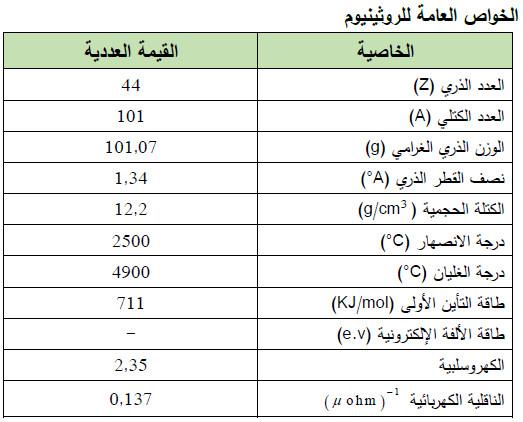
– الجدول التالي يوضح الخواص العامة لعنصر الروثينيوم كما يلي:
اكتشافه ووجوده في الطبيعة Discovery of Ruthenium
– اكتشف من قبل العالم الروسي كلاوس في روسيا سنة 1844م.
– اشتق اسمه من اللاتينية Ruthénie (روثينيا) وهو اسم لاتيني قديم لروسيا الاسم اللاتيني للبلد الذي اكتشف فيه.
– كما يوجد الروثينيوم في الطبيعة في الحالة الفلزية بنسبة ضئيلة مع معادن البلاتين الموجودة في خامات كبريتيد نيكل – نحاس بجنوب إفريقيا وكندا وفي رمال شواطئ بعض الأنهار في روسيا.
– ويعد هذا المعدن من العناصر النادرة إذ نسبة أن وجودها لا تتجاوز %6-10 من وزن القشرة الأرضية.
– علاوة على ذلك فأن هذا المعدن النادر يوجد في خام البنتلانديت Pentlanditelk، وعادة ما يتم استخلاص شكله النقي من هذا الخام، وهو معدن بني مصفر في أعماق الأرض.
طرق تحضير الروثينيوم Preparation of Ruthenium
– يتم استخلاص معدن الروثينيوم (Ru) من معادن البلاتين التي يمكن الحصول عليها كرواسب على الأنود في التنقية الالكتروليتيه للنيكل.
– وتبدأ العملية بإزالة المعادن Pt و Pd و Au من الخام بمعالجته بالماء الملكي (HNO3 – HCl)،
– ثم يلي هذا تسخين الخام مع كربونات الرصاص ثم إضافة حامض النتريك لإذابة الفضة على هيئة نترات فضة.
– وتبقى بعد ذلك مادة صلبة غير قابلة للذوبان تحتوي على أربعة عناصر هي Ru و Os و Rh و Ir والتي يمكن فصلها كما يلي:
الخواص الكيميائية لعنصر الروثينيوم Chemical properties of Ruthenium
(1) التفاعل مع الأكسجين
يتفاعل الروثينيوم مع الأكسجين بالتسخين مشكلاً أكسيد الروثينيوم RuO2 كما بالتفاعل التالي:
Ru + O2 → RuO2
(2) تفاعلات أخرى
– معدن الروثينيـوم لا يتأثر بالأحماض غير المؤكسدة أو ماء الملكي.
– لكن يتفاعل بصعوبة عند درجات الحرارة العالية مع اللافلزات ومع العوامل المؤكسدة.
– يمكن إذابة معدن الروثينيـوم بتعريضها لأبخرة مؤكسدة مثل: Na2O2 , KClO3 فيتحول إلى روثينات -2[RuO4]، كما يمكنه أن يتفاعل مع الهالوجينات.
استخدامات الروثينيوم Uses of Ruthenium
(1) يستخدم في تركيب بعض السبائك.
(2) يستخدم نظير الروثينيـوم-106، في علاج أورام العين وخاصة الورم الميلانيني.
(3) يستخدم مركب ثاني أكسيد الروثينيوم في عدة مكونات في الدوائر الإلكترونية، بما في ذلك المقاومات ذات الغشاء السميك والرقائق الدقيقة لأجهزة الكمبيوتر والأجهزة الرقمية الأخرى.
(4) إضافة كمية صغيرة من الروثينيوم تجعل المعادن أكثر ليونة، مثل البلاتين والبلاديوم، أكثر صلابة حيث تستفيد الأجزاء المتحركة في الأجهزة مثل المفاتيح من هذه الخاصية.
(5) كما يتم تقوية السبائك المعدنية الموجودة في المفتاح بإضافة مادة الروثينيـوم.
(6) علاوة على ذلك بعض الألواح الشمسية منخفضة التكلفة مصنوعة من الروثينيـوم.
تأثير الروثينيوم على جسم الإنسان
– كافة مركباته تسبب التسمم والسرطان وتترك آثاراً من البقع قوية على الجلد.
– كما أن أكسيد الروثينيـوم درجة سميته عالية ومتطاير لذا يجب تجنبه.
المراجع: دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر.