البراسيوديميوم Praseodymium الخواص الفيزيائية والكيميائية
محتويات الموضوع
ما هو عنصر البراسيوديميوم Praseodymium؟
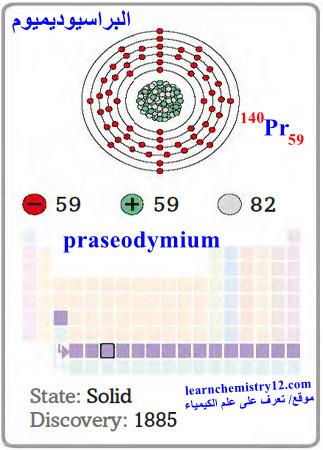
– البراسيوديميوم Praseodymium هو عنصر من عناصر الجدول الدوري: العدد الذري = 59 ، العدد الكتلي = 140.9
– الرمز الكيميائي لعنصر البراسيوديميوم يرمز له بالرمز: 140Pr59
– التوزيع الإلكتروني له: Xe]54 6s2 4f3]
– البراسيوديميـوم معدن ناعم فضي اللون ينتمي لمجموعة اللانثانيدات يتميز بمقاومته للتآكل في الهواء.
-غالبًا ما يتم تخزين الشكل النقي للعنصر في زيت معدني لمنعه من التفاعل مع الأكسجين الموجود في الهواء.
– عادةً ما يكون اللون رماديًا عندما يكون نقيًا ، يتفاعل العنصر ببطء عند ملامسته للهواء لتشكيل طبقة على سطح المعدن
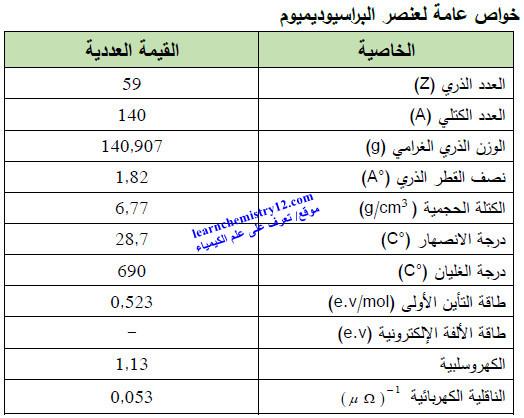
– الجدول التالي يوضح الخواص العامة لعنصر البراسيوديميـوم كما يلي:
اكتشافه ووجوده في الطبيعة Discovery of Praseodymium
– يأتي اسم البراسيوديميوم من الكلمة اليونانية prasinos ، والتي تعني أخضر.
– في عام 1841م استخلص كارل جوستاف موساندر أحد الأتربة النادرة ويسمى ديديميوم من مادة اللانثيوم.
– بالإضافة إلى ذلك ففي عام 1874م تمكن بيير تيودور كليف من استنتاج أن الديديميوم يتكون حقيقة من عنصرين.
– في عام 1879م عزل العالم ليكوك دي بواسبادران عنصر جديد من عناصر الأتربة النادرة، وهو الساماريوم وذلك من مادة الديديميوم السابق ذكرها.
– عام 1885م تمكن الكيميائي الأسترالي البارون كارل ويلسباخ من فصل مادة الديديميوم إلى عنصرين هما براسيودميوم ونيومدميوم.
– يتواجد البراسيوديميـوم بكميات صغيرة في القشرة الأرضية وتبلغ حوالي 9.5 أجزاء من المليون.
– علاوة على ذلك يوجد في معادن التربة النادرة مثل مونازیت، و باستناسيت، وعادة ما يكون نسبة 5% من اللانثانيدات الموجودة فيها.
تحضير البراسيوديميوم Preparation of Praseodymium
– معدن البراسيوديميوم متوفر تجارياً حتى أنه ليس من الضروري توفيره في المختبر، إلا أن عملية فصله كمعدن نقي صعبة جداً، فهي تعتمد أساساً على استخلاص أملاح المعدن من مصدره الطبيعي.
– عملية الاستخلاص تتم بحمض الكبريتيك H2SO4، حمض الهيدروكلوريك (HCl) وهيدروكسيد الصوديوم (NaOH) وهي طريقة جديدة مطورة تعتمد على تقنية التبادل الأيوني كروماتوغرافيا.
– كما يمكن توفير البراسيوديميـوم النقي باختزال PrF3 بمعدن الكالسيوم تحت درجة حرارة 50 درجة مئوية، ثم يتم إزالة الكالسيوم الزائد من خليط التفاعل تحت الفراغ وفق التفاعل التالي:
2PrF3 + 3Ca → 2Pr + 3CaF2
مركبات البراسيوديميوم Praseodymium Compound
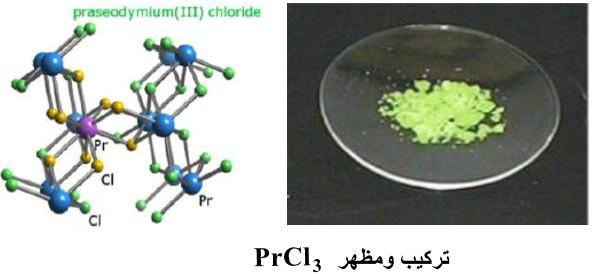
(1) ثلاثي كلوريد البراسيوديميوم PrC13
– هو مركب كيميائي غير عضوي صلب لونه أخضر.
– كما يمتص الماء بسهولة عند تعرضه للرطوبة.
– يتم تحضيره عن طريق تفاعل كلور الهيدروجين مع البراسيوديميوم كما بالتفاعل التالي:
2Pr + 6HCl → 2PrCl3 + 3H2
– ويمكن تحضير الأملاح المائية لثلاثي كلوريد البراسيوديميـوم عن طريق مزج معدن البراسيوديميوم أو كربونات البراسيوديميـوم مع حمض الهيدروكلوريك كما بالتفاعل التالي:
Pr2(CO3)3 + 6HCl +15H2O → 2[Pr(H2O)9]Cl3 + 3CO2
– كما يمكن تحضيره عن طريق إزالة الماء ثرموديناميكياً تحت درجة حرارة 400Co في وجود كلوريد الأمونيوم أو كلوريد الثيونيل.
– ثلاثي كلوريد البراسيوديميـوم هو حمض لويس، محاليله المائية يمكن أن تحضر مركبات البراسيوديميـوم المنحلة في الماء كما بالتفاعلات الآتية:
PrCl3 + K3PO4 → PrPO4 + 3KCl
PrCl3 + 3NaF → PrF3 + 3 NaCl
– وعند تخزينها مع الفلزات القلوية، فإنها تشكل سلسلة ثلاثية (مركبات تحتوي على ثلاثة عناصر مختلفة) بالصيغ الآتية كما يلي:
M3Pr2Cl7 , MPr2Cl7 , MPr2Cl6 , M2PrCl5
حيث أن (M = K , Rb , Cs)
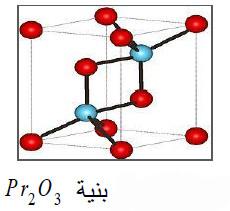
(2) ثلاثي أكسيد ثنائي البراسيوديميوم Pr2O3
– هو مركب كيميائي ذو بلورات بيضاء تشكل بنية سداسية.
– كما يمكن استخدامه في لحام النظارات الواقية لأنه يقي من الأشعة تحت الحمراء.
(3) أندي أكسيد هكسا البراسيوديميوم Pr6O11
– يتم تحضيره بتسخين ثنائي أكسيد البراسيوديميوم PrO2 عند درجة الحرارة 305Co.
– وهو عبارة عن مسحوق أسود يذوب في الحمض ليشكل محاليل خضراء أو أملاح خضراء تستخدم في صناعة الخزف، الطلاء وتلوين الزجاج.
(4) ثلاثي سيلفات البراسيوديميوم Pr2(SO4)3
– هو مركب كيميائي عديم الرائحة لونه أخضر كما بالشكل التالي، له بنية بلورية.
– يكون مستقر تحت الظروف القياسية وفي درجة الحرارة المرتفعة يفقد الماء تدريجياً ويصبح أكثر بياضاً.
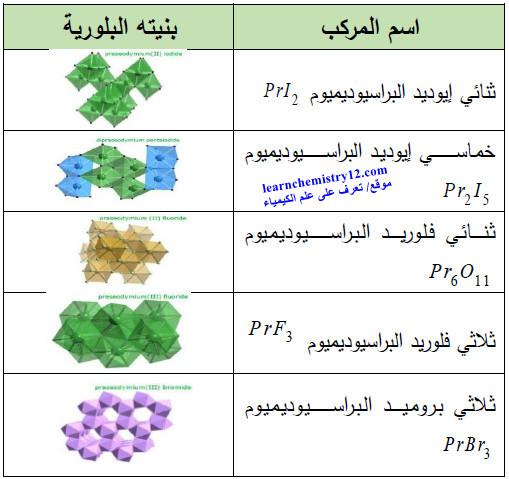
(5) مركبات أخرى
– الجدول التالي يوضح أهم مركبات البراسيوديميوم الأخرى المشهور كما يلي:
الخواص الكيميائية لعنصر البراسيوديميوم Chemical properties of Praseodymium
– البراسيوديميوم أكثر مقاومة للتآكل في الهواء من اللانثيوم الأربيوم والسيريوم، لكنه ينتج أكسيد أخضر اللون يغطي الجزء المعرض من المعدن للهواء ما يؤدي بالأجزاء الداخلية للتأكسد.
– ولهذا السبب يجب حفظ البراسيوديميوم مغطى بطبقة عازلة من الزيت المعدني الخفيف مغلف بالزجاج.
(1) التفاعل مع الهواء
– يتشوه البراسيوديميوم ببطء في الهواء ويحترق بسهولة لتشكيل أكسيد البراسيوديميوم كما بالتفاعل التالي:
12Pr + 11O2 → 2Pr6O11
(2) التفاعل مع الماء
– للبراسيوديميوم كهروإيجابية عالية لذا فهو يتفاعل ببطء مع الماء البارد وبسرعة مع الماء الساخن لتشكيل هيدروكسيد البراسيوديميوم ((ويصحب هذا التفاعل انطلاق غاز الهيدروجين H2
2Pr(s) + 6H2O(g) → 2Pr(OH)3(aq) + 3H2(g)
(3) التفاعل مع الهالوجينات
البراسيوديميوم يتفاعل مع كل الهالوجينات ليشكل هاليدات البراسيوديميوم الثلاثية ومنه يتفاعل مع الفلور والكلور والبروم واليود ليشكل على التوالي: ثلاثي فلوريد البراسيوديميـوم، ثلاثي كلوريد البراسيوديميـوم، ثلاثي بروميد البراسيوديميـوم، ثلاثي يوديد البراسيوديميـوم، كما بالتفاعلات التالية:
أخضر 2Pr(s) + 3F2(g) → 2PrF3(s)
أخضر 2Pr(s) + 3Cl2(g) → 2PrCl3(s)
– أما فى حالة البروم واليود يكون كما يلي:
أخضر 2Pr(s) + 3Br2(g) → 2PrBr3(s)
2Pr(s) + 3I2(g) → 2PrI3(s)
(4) التفاعل مع الأحماض
– البراسيوديميـوم معدن ينحل بسهولة في حمض الكبريتيك لتشكيل محاليل تحتوي على اللون الأخضر كما بالتفاعل التالي:
2Pr(s) + 3H2SO4(aq) → 2Pr3+(aq) + 3SO42-(aq) + 3H2O
استخدامات البراسيوديميوم Uses of Praseodymium
(1) يستخدم كمادة أساسية في أقواس الكربون المضيئة التي تستخدم في صناعة الأفلام السينمائية.
(2) أملاحه تستخدم لتلوين سطوح النظارات وذلك بمزجه مع مواد أخرى، كما أنه عامل أساسي في صناعة النظارات الواقية.
(3) يستخدم لصناعة ولاعات السجائر (يمثل نسبة 5% منه)
(4) تعطي مركبات البراسيوديميوم لونًا أصفر للزجاج والسيراميك المقاوم للحرارة، وتوفر لونًا أخضر لبعض الجواهر الاصطناعية.
(5) يعزز هذا العنصر أيضًا قوة المغناطيسات التي تحتوي عليه.
تأثير البراسيوديميوم على جسم الإنسان
– البراسيوديميوم كعنصر من عناصر الأتربة النادرة فإنه يتميز بنسبة سمية منخفضة إلى متوسطة، إلا أنه يجب الحذر عند استعماله لأنه مادة مهيجة للعيون.
تأثير البراسيوديميوم على البيئة
– غباره المعدني خطير وقد يحدث انفجارًا أو اشتعالاً.
– المراجع:
- دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر.
- The periodic table book – A visual Encyclopedia of elements written by Tom Jackson – consultant Jack Challoner – Great Britain 2017