تحضير البيرول Preparation of Pyrrole
في هذا الموضوع سيتم مناقشة جميع طرق تحضير البيرول Pyrrole ولكن سنتكلم أولاً عن بعض الصفات المميزة لهذا المركب.
الصيغة الكيميائية للبيرول Chemical formula of Pyrrole
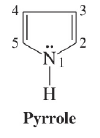
البيرول هو مركب عضوي من المركبات الحلقية الغير متجانسة لأنه يحتوي على ذرة واحدة غير متجانسة وهي النيتروجين.
لماذا يعتبر البيرول من المركبات العضوية؟
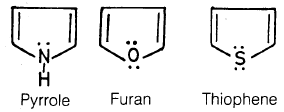
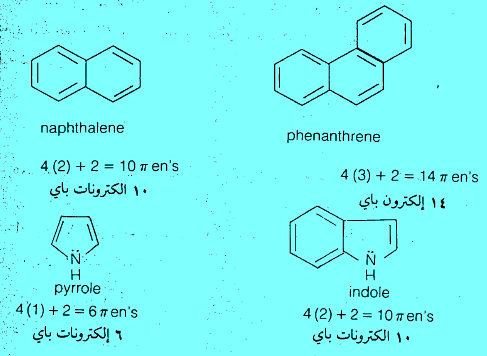
– أوضح روبنسون (Robinson) عام 1924م لأول مرة أن البيرول والفيوران والثيوفين تشبه البنزين ومشتقاته إلى حد كبير.
حيث تشارك كل ذرة كربون من الذرات المكونة للحلقة بإلكترون واحد وتشارك الذرة غير المتجانسة بإلكترونين في تكوين تلك السحابة الإلكترونية المكونة من (6) إلكترونات والتي تعطي الصفة الأروماتية لهذه المركبات وهذا يعنى أن مركبات البيرول والفيوران والثيوفين تشبه البنزين ومشتقاته إلى حد كبير.
أماكن تواجد البيرول Pyrrole
– لقد تم اكتشاف مادة البيرول في أوائل القرن التاسع عشر حيث يوجد البيرول كميات قليلة في قطران الفحم وزيت العظام.
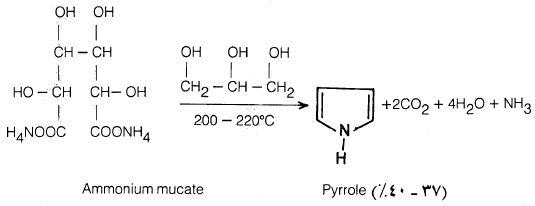
– يمكن أن يحضر بصورة نقية عن طريق تقطير ميوكات الأمونيوم، ولاتزال هذه الطريقة من الطرق المخبرية المستخدمة بتحضيره.
– وما لبث النظام الحلقي للبيرول أن أصبح موضع اهتمام كبير حيث إنه وجد في كثير من المركبات المنتشرة في الطبيعة.
– يوجد البيرول في الهيمين الموجود في الدم ومادة الكلوروفيل في النبات بالإضافة إلى مركبات القلويدات وعليه فإن لمادة البيرول أهمية حيوية كبيرة.
الخواص الفيزيائية للبيرول Physical properties of Pyrrole
- البيرول سائل عديم اللون.
- يغلي عند درجة حرارة 129°م وعند 760مم زئبق.
- كثافة البيرول تصل إلى 0.968 جم/سم3
- البيرول حمض ضعيف وقاعدة ضعيفة جداً.
- البيرول له رائحة تشبه رائحة الكلوروفورم .
- يتغير لونه إلى البني إذا ترك معرضاً للهواء الجوي.
- له قابلية الامتزاج مع معظم المذيبات العضوية.
- ويذوب بنسبة قليلة تصل إلى 6% في الماء.
- الرابطة الهيدروجينية تتكون بين جزيئات البيرول، ويدل على ذلك انخفاض درجة غليان 1- ميثيل بيرول (١١٤ – ١١٥ مo) وكـذلك طيف الأشعة تحت الحمراء ( IR) للبيرول نفسه.
إثبات الصيغة الكيميائية للبيرول
– تكتب صيغة البيرول عادةً كالتالي:
– لقد أثبتت الدراسـات بواسطة الميكروويف (Microwaves) أن جزيء البيرول عبارة عن حلقة توجد في مستوى واحد. وأن أطوال روابط هذه الحلقة تكون وسطاً بين أطوال الروابط الأحادية والثنائية سواء كان ذلك بالنسبة لروابط C = C أو C = N ومن ذلك يتضح أن صيغة البيرول (1) الموضحة أعلاه لا تمثل البيرول بكل دقة.
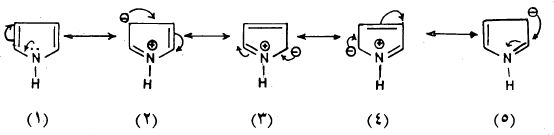
– وعليه فإننا يجب أن نتعرض للبيرول كهجين ناتج من عدة صيغ تأرجحية (طنين).
– ومن جهة أخرى نجد أن للبيرول خاصية أروماتية ناتجة من عدم استقرار (لاموضعية) الزوجين الإلكترونين في كل من رابطتي π وزوج الإلكترونات الحرة على الذرة غير المتجانسة (النيتروجين) حيث إن هذه الستة إلكترونات تشكل سحابة إلكترونية فوق وتحت مستوى الجزيء تدور في مدار حلقي داخل الجزيء.
– ولقد تأكدت الصفة الأروماتية لحلقة البيرول من:
(1) وجود سحابة إلكترونية (π – Cloud) فوق وتحت مستوى الجزيء.
(2) قياس أطوال الروابط وكونها وسط بين الروابط الأحادية والثنائية.
(3) وجود عدة صيغ تأرجحية تمثل الصيغة التركيبية للبيرول والتي يمكن تمثيلها كما يلي:
والهجين التأرجحي (الرنين) لهذه الصيغ يمكن أن يعبر عنه بالشكل:
(4) بالإضافة إلى قياس العزم القطبي وحرارة الاحتراق.
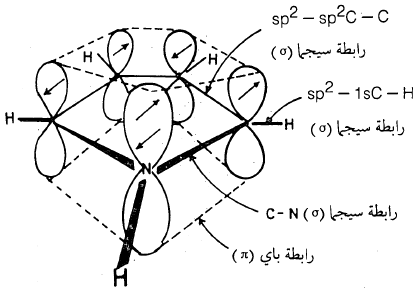
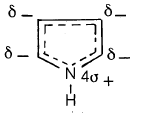
– هذا ويمكن تمثيل المدارات الذرية للبيرول بالشكل (1) حيث يتضح أن كل ذرة كربون وكذلك ذرة النتروجين تتصل بثلاث ذرات أخرى مستخدمة مدارات من نوع sp2 ذات زاوية تقدر بـ 120o.
وعليه فإن كل ذرة كربون وكذلك ذرة النتروجين تحمل مدار (P) به إلكترون واحد يمكن أن تتداخل مع بعضها مشكلة سحابة باي π.
– الشكل التالي يوضح المدارات الذرية لمركب البيرول:
الطرق العامة لتحضير البيرول Preparation of Pyrrole
يوجد البيرول ومشتقاته في قطران الفحم وبعض النباتات ومن الطرق المعملية لتحضيره:
(1) إمرار خليط من الفيوران والأمونيا على الألومينا الساخنة كعامل مساعد:
(2) إمرار خليط من الأمونيا والأسيتيلين في أنبوب ذي درجة حرارة عالية:
(3) تسخين ثنائي الأسيتيلين مع الأمونيا أو أحد مشتقاتها عند درجة حرارة 140o-160o وفي وجود كلوريد النحاسوز يعطي البيرول أو أحد مشتقاته حسب نوع المجموعات R وRؘ
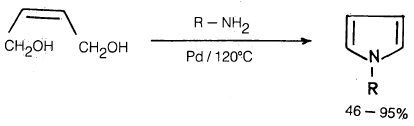
(4) تسخين مركب Cis – 2 – butene – 1,4 – diol مع الأمينات الأولية في وجود عامل مساعد مثل البلاديوم (Pd) يعطي ناتجاً ممتازاً من البيرول.
(5) تسخين 4.1- ثنائي مجموعة الكربونيل مثل سكسينالدهيد مع كربونات الأمونيوم NH4)2CO3)
(6) تقطير خليط من ميوكات الأمونيوم مع الجلسرول عند درجة حرارة 220-200مo حيث يتكون البيرول بالإضافة إلى ثاني أكسيد الكربون والماء والأمونيا، وهذه طريقة جيدة لتحضير البيرول لسهولة فصله من النواتج الجانبية الأخرى.
(7) تقطير سكسيناميد مع مسحوق الخارصين .
وهناك عدة طرق يمكن استخدامها لتحضير البيرول أو مشتقات البيرول نذكر منها :
طريقة بال – كنور لتحضير البيرول Pall – Knorr synthesis
– تمت معرفة هذا التفاعل عام ١٨٨٥م بواسطة العالمان بال ونور.
– ويمكن أن يحضر البيرول أو أحـد مشتقاته بهذه الطريقة وذلك بمعاملة 1, 4. ثنائي كيتون أو 4,1- ثنائي الدهيد بواسطة الأمونيا أو أحد مشتقاتها R-NH2 حيث R تعني:
– وعلى العموم فإنه يمكن أن يعمم هذا التفاعل باستخدام أي مركب يحتوي على 4.1۔ مجموعة الكربونيل مع الأمونيا أو مشتقاتها للحصول على البيرول أو أحد مشتقاته.
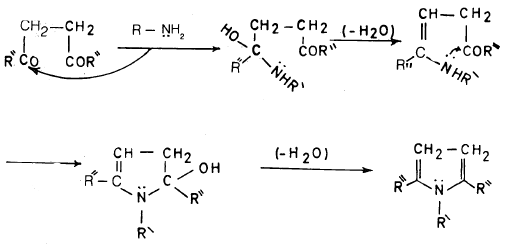
– وبصورة عامة فإن ميكانيكية هذا التفاعل ليست واضحة إلا أنه يمكن اقتراح الخطوات التالية لتوضيح الميكانيكية المحتملة:
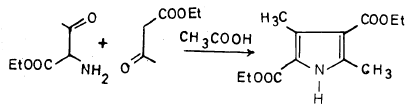
طريقة كنور لتحضير البيرول Knorr pyrrole synthesis
وهي طريقة عامة لتحضير البيرول ومشتقاته، وتعتمد على تكاثف ألفا ـ أمينو كيتون مع بيتا ـ كيتواستر طبقاً للمعادلة التالية:
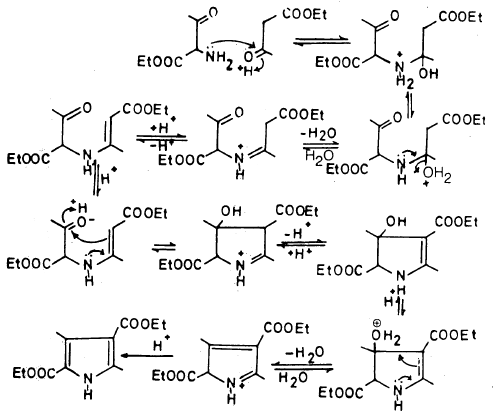
أما ميكانيكية التفاعل فيمكن توضيحها في الخطوات الآتية:
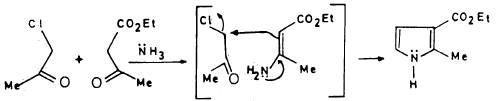
طريقة هانتزش لتحضير البيرول Hantzsch pyrrole synthesis
– تعتمد هذه الطريقة على تكاثف كلورواستون وبيتا ـ كيتواستر والأمونيا أو أمين أولي كما يلي :
ولكن من العوامل التي تحد من استخدام هذه الطريقة في تحضير البيرول ومشتقاته إمكانية تكون الفيوران أو أحد مشتقاته كناتج جانبي.
المراجع:
- كتاب المركبات الحلقية غير المتجانسة والحيوية للدكتور حمد بن عبدالله اللحيدان والدكتور محمد بن إبراهيم الحسن والدكتور سالم سليم الذياب – الطبعة الثانية – جامعة الملك سعود – المملكة العربية السعودية
- كتاب الكيمياء العضوية للمؤلف د.حسن محمد الحازمي / الجزء الثاني


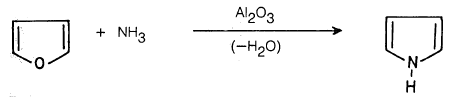

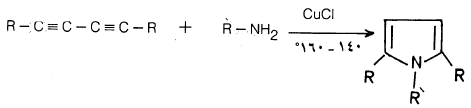
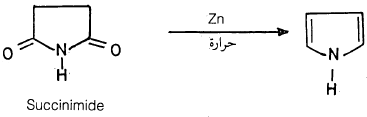
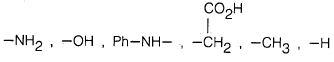
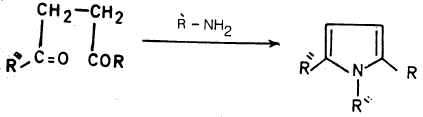




هل يمكن استعمال البيرول في الحفاظ على مشتقات الحليب مثل الزبدة لاطول مدة