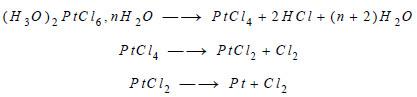البلاتين Platinum – الخواص الفيزيائية والكيميائية
محتويات الموضوع
ما هو عنصر البلاتين Platinum؟
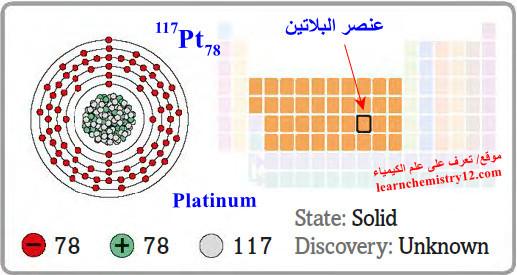
– البلاتين Platinum هو عنصر من عناصر الجدول الدوري: العدد الذري = 78، العدد الكتلي = 195
– الرمز الكيميائي لعنصر البلاتين يرمز له بالرمز: 195Pt78
– التوزيع الإلكتروني له: Xe]54 6s1 4f14 5d9]
– يكون البلاتين النقي ذا لون رمادي فضي، وهو فلز قوي لا يصدأ ولا يفقد بريقه عند تعرضه للهواء لأنه لا يتفاعل مع الأكسجين أو الكبريت الموجودين في الهواء.
– البلاتيـن فلز مرن قابل للسحب، يتمتع بخصائص مستقرة من الناحية الكهربائية وبثبات تجاه المواد الكيميائية، لا يتأثر بدرجات الحرارة المختلفة.
– كما يعتبر أغلى من الذهب إذ قد تصل قيمته على حوالي ضعف قيمة الذهب.
– البلاتيـن النقي لا يتآكل أو يفقد بريقه ومع ذلك، ليس من السهل تشكيله أو قولبته.
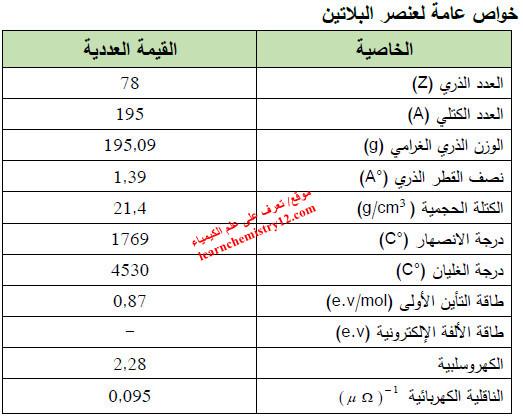
– الجدول التالي يوضح الخواص العامة لعنصر البلاتين كما يلي:
اكتشافه ووجوده في الطبيعة Discovery of Platinum
– اكتشف من قبل العالم (وليام وود) سنة 1741م.
– كلمة بلاتين ذات أصل إسباني (platine) وتعني الفضة.
– يعد البلاتيـن نادر الوجود يبلغ تركيزه 0.003 جزء من المليون جزء في القشرة الأرضية، وقد يحدث عدم التمييز بينه وبين الفضة في كثير من الأحيان.
– نادراً ما يتفاعل البلاتين مع العناصر الأخرى، حتى في درجات الحرارة المرتفعة. وهذا يجعل من الصعب استخراجه من خاماته.
– غالباً ما يوجد البلاتيـن بشكل حر غير مرتبط كيميائياً، ويكون مختلطاً مع الإريديوم على هيئة إريديوم البلاتين (Ir, Pt)
– كما يوجد البلاتين في أغلب الأحيان في ترسبات ثانوية مختلطاً مع معادن أخرى من مجموعته، لقد وجدت ترسبات ضخمة في جبال الأورال الروسية وهي قيد الاستثمار.
– توجد مجموعة معادن البلاتيـن في ترسبات النيكل والنحاس على هيئة كبريتيد مثلاً: (Pd, Pt)
– يشكل زرنيخيد البلاتين (PtAS2) المصدر الأهم للبلاتين المرافق لفلزات النيكل في ترسبات حوض سودبري في أونتاريو بكندا.
– معدن Sperrylite هو معدن كثيف لامع الذي يتكون من البلاتيـن والزرنيخ هو خام البلاتيـن الأكثر شيوعاً.
تحضير البلاتين Preparation of Platinum
– يوجد البلاتين الخام في ترسبات غروانية، أو مع فلزات أخرى ويتم عزله عن فلزات مجموعته واستخلاصه من الشوائب وفق طرائق عدة:
(1) بما أن البلاتيـن أشد كثافة بكثير من شوائبه، يمكن إزاحة الشوائب الأقل كثافة منه من خلال تطويفها في حمام مائي.
(2) البلاتين غير قابل للمغنطة إلا أن النيكل والحديد فلزان مغناطيسيان. وهذا ما يسمح بإزالتهما عن طريق تمرير مغناطيس كهربائي فوق الخليط.
(3) ونظراً لتمتع البلاتيـن بدرجة انصهار أعلى بكثير من درجة انصهار بقية الشوائب، فإنه بالإمكان حرقها وإزالتها بالصهر دون صهر البلاتين.
(4) وأخيراً الطريقة المثلى لتنقية البلاتين الخام الحاوي على البلاتيـن، الذهب والمعادن الأخرى من المجموعة البلاتينية، هي معالجته بالماء الملكي الذي ينحل فيه كل من البلاتيـن البلاديوم والذهب، في حين يبقى كل من الأوزيميوم، الإريديوم، الروتينيوم والروديوم دون انحلال، ثم يتم ترسيب الذهب بإضافة كلوريد الحديد وبعد فترة الذهب يتم ترسيب البلاتين بإضافة كلوريد الأمونيوم على هيئة كلوريد بلاتينات الأمونيوم NH4)PtCl3) ويمكن تحويل هذا المركب الأخير إلى البلاتيـن الصافي من خلال تعريضه للحرارة.
مركبات البلاتين Platinum Compounds
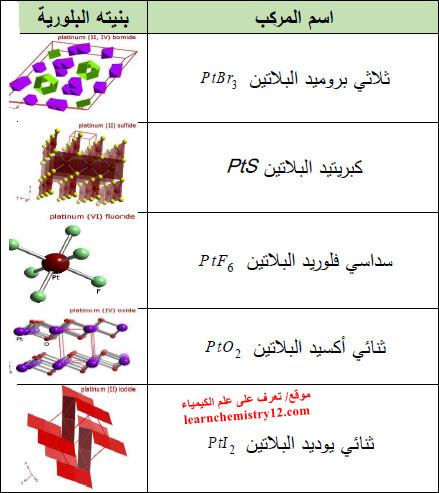
– الجدول التالي يوضح أهم مركبات البلاتين كما يلي:
الخواص الكيميائية لعنصر البلاتين Chemical properties of Platinum
– يتأكل البلاتين بوجود الهالوجينات السيانيدات والمعادن الأساسية.
– لا ينحل البلاتيـن في حمض الهيدروكلوريك أو حمض الأزوت لوحدهما. وإنما ينحل في الماء الملكي مشكلاً حمض كلوريد البلاتيـن H2PtCl6
– يتحد البلاتين مع الزرنيخ، الفوسفور والسيليكون بسهولة. ويشكل أيضاً سبائك مع معظم الفلزات.
HCl + Pt + 4HNO3 → H2PtCl6 + 4NO2 + 4H2O
– لهذا المركب H2PtCl6 ، تطبيقات عديدة في التصوير ، الطلاء، الحفر على الزنك، المرايا والتحفيز .
– إن معالجة هذا المركب مع ملح أمونيوم، مثل: كلوريد الأمونيوم يعطي سداسي كلوريد بلاتينات الأمونيوم NH4)PtCl3) غير قابل للانحلال في محاليل الأمونيوم وأن تعريض هذا المركب الأخير للحرارة بوجود الهيدروجين يرجعه إلى عنصر البلاتيـن. وهكذا يمكن عزل البلاتيـن من فلزاته وإعادة بلورته.
– عندما يسخن حمض سداسي كلوريد البلاتيـن Chloroplatinic acid فإنه يتفكك إلى كلوريد البلاتيـن (4+) وكلوريد البلاتيـن (2+) ليعطي البلاتين، وفق التفاعلات التالية:
– إن التفاعلات الثلاث عكوسة ويعد سداسي فلوريد البلاتين مؤكسداً قوياً قادراً على أكسدة الأكسجين.
– كما يعرف أكسيد البلاتيـن الرباعي PtO2 بحافز (آدمز) وهو عبارة عن مسحوق أسود ينحل في محاليل هيدروكسيد البوتاسيوم KOH وفي الأحماض المركزة.
– جرى تصنيع عدة مركبات لبروميد البلاتيـن، حيث يظهر البلاتين فيها درجات أكسدة سالبة تأخذ القيم (1-) و (2-) ونذكر منها: BaPt, Ba2Pt.
استخدامات البلاتين Uses of Platinum
(1) إن الاستخدام الأكثر شيوعاً للبلاتيـن يكمن في التحفيز الكيميائي. إذ يستخدم في هذا المجال منذ بداية القرن الثامن عشر، عندما أستعمل مسحوق البلاتين لتحفيز اشتعال الهيدروجين.
(2) إن الاستخدام الأكثر أهمية في مجال السيارات هو المحول التحفيزي الذي يسمح بالاحتراق الكامل للتراكيز الضعيفة للهيدروكربونات غير المحترقة للتحول إلى ثنائي أكسيد الكربون وبخار الماء.
(3) يستخدم البلاتين في الصناعة النفطية كمحفز لعدد من عمليات الفصل. وخاصة تكسير السلاسل النفطية المفتوحة بهدف جعل الوقود عالي الأوكتان، أي جعله غنياً بالمركبات العضوية.
(4) يستخدم PtO2 المعروف بحافز آدمز كحافز هدرجة وبشكل خاص في حالة الزيوت النباتية. كما يمكن للبلاتيـن أن يحفز بقوة تفكك الماء الأكسجيني إلى ماء وغاز الأكسجين.
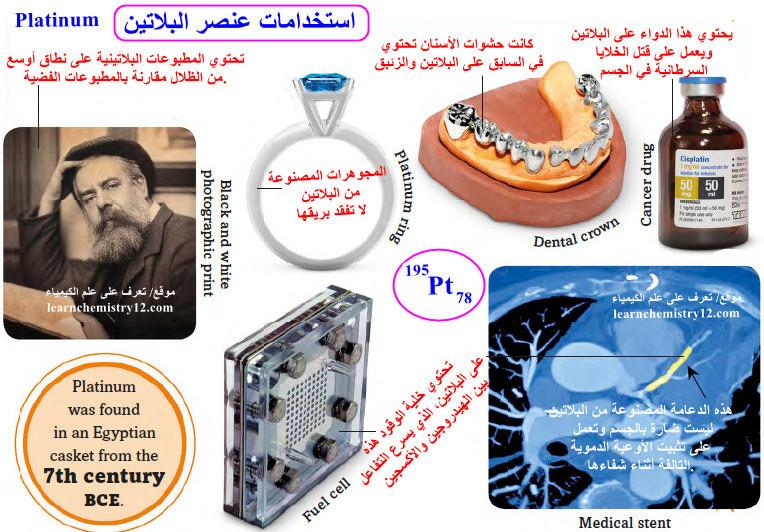
(5) يدخل البلاتين في صناعة المجوهرات بشكل واسع لما يتمتع به من قوة وصلابة بالإضافة إلى عدم تأثره بالمواد المزيلة للبريق، وخموله الكيميائي كما يستعمل في صناعة ساعات اليد باهظة الثمن.
(6) استعمل قضيب مكون من مزيج (بلاتيـن / إريديوم) بنسبة (90/10) كمعيار للطول المتري منذ عام 1889م. وعرف بالقضيب المتري المعياري الدولي، في حين صنع القضيب المعياري الأسبق من البلاتيـن الخالص. كما أن الكيلوغرام المعياري الدولي الذي صنع كأسطوانة من المزيج نفسه عام 1879م مازال حتى تاريخنا هذا.
استخدامات مهمة أخرى
(7) بسبب خصائص البلاتين الجيدة ومقاومته للتأكل. فهو يستخدم في تصنيع إلكترود الهيدروجين المعياري.
(8) يستخدم البلاتيـن في السبائك المعدنية لصنع الأسلاك والأوعية المقاومة للتآكل المستعملة في المختبرات.
(9) كما يستخدم في صناعة أفضل الأدوات الجراحية وفي طب الأسنان أما مركباته تستعمل في علاج بعض حالات السرطان.
(10) يمكن استخدام البلاتيـن بدلاً من الفضة لإنتاج مطبوعات فوتوغرافية. وبدلاً من الذهب لصنع حشوات الأسنان، حيث كانت حشوات الأسنان تحتوي في السابق على البلاتين والزئبق.
(11) تساعد الدعامات المصنوعة من البلاتين النقي على شفاء الأوعية الدموية التالفة.
(12) يتم استخدامه في خلايا الوقود – الأجهزة التي تولد الكهرباء عن طريق الجمع بين الهيدروجين والأكسجين- ولا تحتاج هذه الخلايا إلى إعادة شحنها مثل البطاريات الأخرى.
(13) يسجل مقياس الحرارة (الترمومتر البلاتيني) درجة الحرارة عن طريق قياس التيار الكهربائي المتدفق عبر سلك بلاتيني ناعم.
تأثيره على الإنسان
– أثبتت مراكز مراقبة الأمراض والوقاية منها أن التعرض لأملاح البلاتين ولو لمدة قصيرة، يمكن أن يسبب إثارة للعينين، الأنف والحنجرة، أما التعرض طويل الأمد فيمكن أن يسبب حساسية للمجاري التنفسية.
– نظراً لاستخدام البلاتين كوسيط في صناعة المطاط السيلكوني ومكونات أنماط عديدة من مراهم الزراعات الطبية (زراعة الثدي، الجراحات الترقيعية، الفقرات العظمية وصمامات الأوعية الدموية) فهناك احتمال لتشكل جذور حرة من البلاتين ودخولها الجسم مسببة تأثيرات معاكسة تستحق الدراسة.
– المراجع:
- دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر.
- The Periodic Table Book – A Visual Encyclopedia of Elements written by Tom Jackson – consultant Jack Challoner – Great Britain 2017