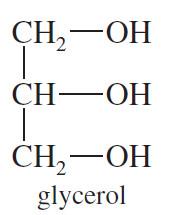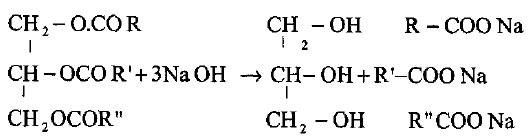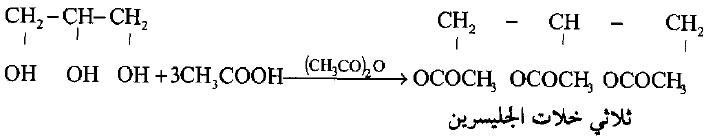الجليسرول Glycerol (طرق التحضير – التفاعلات – الاستخدامات)
الجليسرول Glycerol
– الجليسرول هو أحد الكحولات ثلاثية الهيدروكسيل حيث يعتبر المكون الرئيسي للجيليسريدات ويوجد في شحوم الحيوانات وزيوت النباتات.
– تم اكتشاف الجليسرول من قبل العالم شيل scheele عام 1779 م كناتج التحلل المائي لزيت الزيتون.
– يوجد في الطبيعة في صورة إسترات للأحماض الدهنية العالية (الأحماض الأليفاتية) مثل حمص البالميتيك والستياريك.
– هو عبارة عن جزئ بروبان استبدلت ذرة هيدروجين من كل ذرة كربون بمجموعة هيدروكسيل.
– كذلك يطلق عليه تجارياً Glycerin.
أهم خواص الجليسرول
– يتميز الجليسرول بالصفات التالية كما يلي:
- سائل سميك القوام.
- عديم اللون.
- عديم السمية.
- حلو الطعم.
- يذوب بلا حدود فى الماء.
- لا يذوب أطلاقاً في الأثير.
- ذو لزوجة عالية.
- يمتزج بالماء امتزاجاً تاماً.
- عند تجفيفة من الماء فأنه يكون بلورياً (درجة الانصهار 18oم) عند تبريده تحت الصفر.
- يغلى عند 290o
- صفاته الكيميائية مشابه للكحولاث الثلاثية.
- يستخدم كمضاعفات للأطعمة والتبغ ومستحضرات التجميل لحفظ طبيعتها المرطبة.
طرق تحضير الجليسرول
(1) من الزيوت والدهون
– يحضر الجليسرول أساساً من الزيوت والدهون نباتية أو حيوانية حيث يوجد على هيئة إستر للأحماض الدهنية العالية وتسمى جليسريدات – بالتحلل المائي – وذلك بتسخينها مع الصودا الكاوية أو ببخار الماء فوق المسخن وتحت ضغط، ويفصل المحلول المائي المشتمل على الجليسرول كما فى المعادلة التالية:
(R” ، Rٌ ، R) مجموعات الكيلية عالية إما أن تكون مشبعة أو غير مشبعة كما أنها قد تكون متشابهة أو مختلفة.
– يبخر الماء منه تحت ضغط ثم يقطر الجليسرول مع بخار الماء فوق المسخن تحت ضغط عالي نحصل على جليسرول نقي.
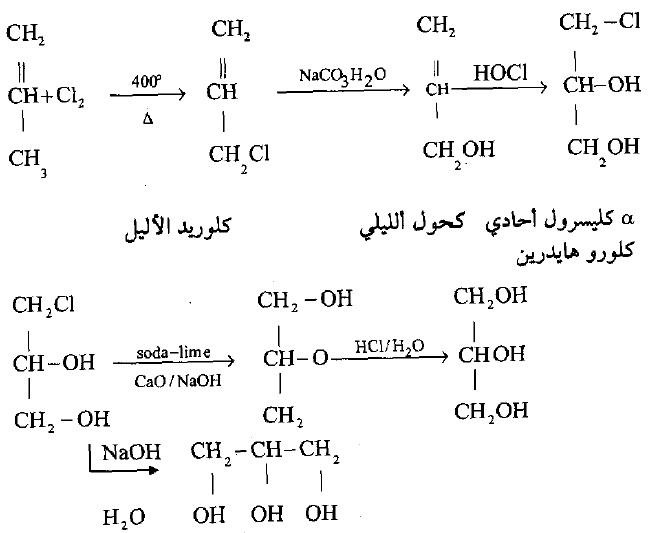
(2) من البروبيلين
– يحضر صناعياً أيضاً من أحد نواتج البترول وهو البروبيلين.
– تتم هذه العملية بتفاعل الكلور مع البروبيلين عند درجات حرارة مرتفعة 400o م ولذلك فهو يتفاعل بميكانيكية الشقوق الحرة – مع مجموعة الألكيل بالإبدال في حالة الألكانات.
– أما إذا تفاعل بالإضافة فإن ثنائي الكلورو الذي قد ينتج غير ثابت عند درجات الحرارة المرتفعة فيتفكك إلى البروبيلين والكلور.
تفاعلات الجليسرول
– يحتوي جزئ الجليسرول على مجموعتين هيدروكسيل أولية ومجموعة واحدة ثانوية لذلك فهو يعطى تفاعلات الكحول الأولية والثانوية.
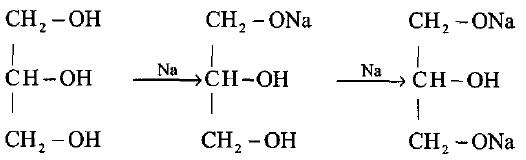
(1) مع الصوديوم
– يتفاعل الجليسرول مع الصوديوم في درجة حرارة الغرفة حيث تستبدل ذرة هيدروجين من إحدى مجموعات الهيدروكسيل الأولية بذرة صوديوم ليعطى مشتق أحادي الصوديوم.
– ثم تتفاعل مجموعة الهيدروكسيل الأولية الأخرى تحت ظروف أكثر صعوبة ليعطى مشتق ثنائي الصوديوم كما فى المعادلة التالية:
– أما مجموعة الهيدروكسيل الثانوية فلا تتفاعل، وأملاح الصوديوم الناتجة تتحلل مائياً بسهولة وتعطى الجليسرول.
(2) مع الأحماض المعدنية
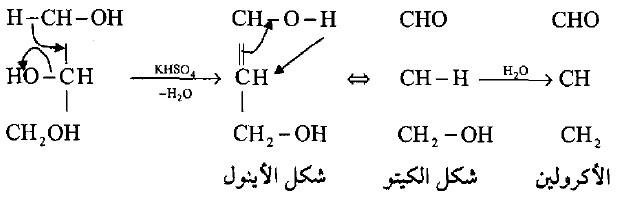
(أ) مع حمض الكبريتيك المركز
– يفقد الجليسرول جزيئتين من الماء عند تسخينه مع حمض الكبريتيك المركز أو كبريتات البوتاسيوم الهيدروجينية مكوناً الأكرولين كما فى المعادلة التالية:
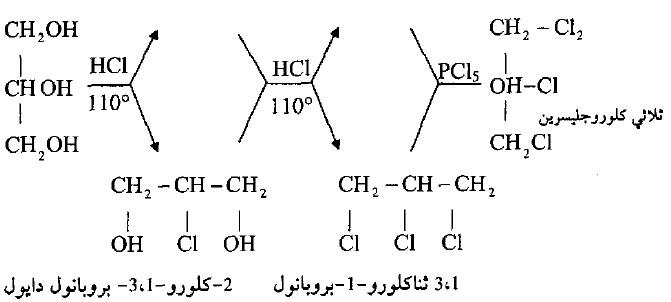
(ب) مع حمض الهيدروكلوريك
– يتفاعل الجليسرول مع كلوريد الهيدروجين أو بروميد الهيدروجين عند 10o م ليعطى خليط من β ، α – كلورو – أو برومو هيدرزين يكون فيه نسبة المشتق – α بكمية عالية.
– بزيادة كمية هاليد الهيدروجين يتكون مخلوط من ثنائي الهاليد وتكون نسبة المشتق α – ، α – ثنائي الهاليد عالية، وعند معالجة الناتج بخامس هاليد الفوسفور يعطى ثالث هاليد الجليسرول كما فى المعادلة التالية:
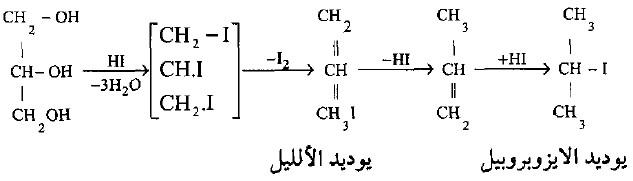
– أما عند تسخين الجليسرول مع يوديد الهيدروجين أو مع ثالث يوديد الفوسفور فأنه يعطى في المرحلة الأولى من التفاعل ثلاثي يوديد الجليسريل وبزيادة تركيز الحامض يعطى بروبيلين ثم يوديد أيزوبروبيل وهذا يتوقف على تركيز يوديد الهيدروجين ودرجة حرارة التفاعل.
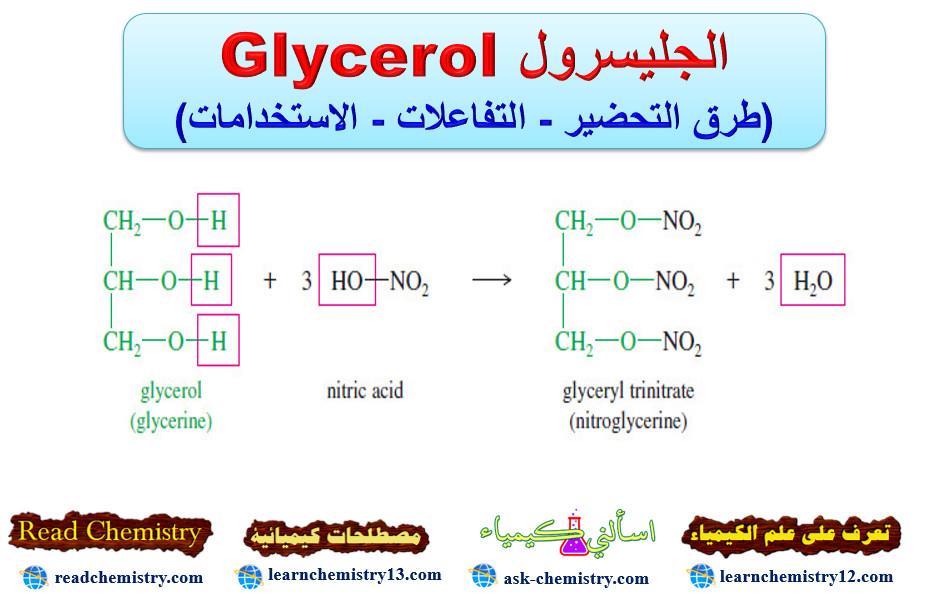
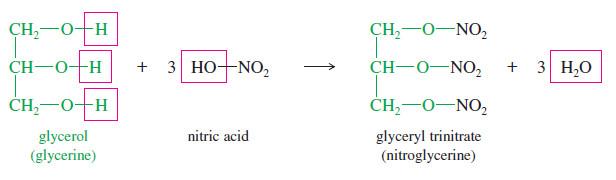
(جـ) مع مخلوط من حمضي النيتريك والكبريتيك
– يتفاعل الجليسرول مع حمض النيتريك المركز في وجود حمض الكبريتيك المركز ليعطي إستر ثلاثي يسمى استر ثلاثي نترات الجليسريل ( نیترو جليسرول).
– يتم التفاعل بإضافة الجليسرول اللامائي مع التقليب إلى مخلوط بارد من حمض النيتريك وحمض الكبريتيك المركزين.
– فائدة حمض الكبريتك فى هذا التفاعل هو نزع الماء كما فى التفاعل التالي:
(3) مع الأحماض العضوية
– يتفاعل الجليسرول مع الأحماض العضوية وانهيدريداتها في وجود عامل نازع للماء ليعطى استرات.
– كما يتوقف ناتج التفاعل على ظروف التفاعل من قوة مخلوط الأسيلة ودرجة حرارة التفاعل.
– يلاحظ أن الأحماض الكربوكسيلية تتفاعل أولاً مع مجموعة الهيدروكسيل الأولية ثم الثانوية.
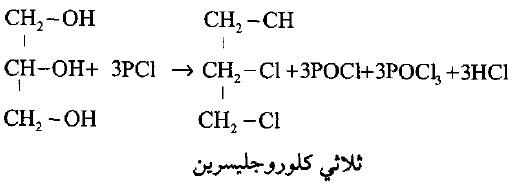
(4) مع هاليدات الفوسفور
– يتفاعل الجليسرول مع خامس بروميد الفوسفور ليعطى ثلاثي هاليد الجليسريل كما بالتفاعل التالي:
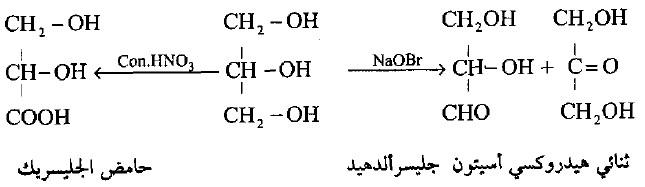
(5) الأكسدة
– يعطى الجليسرول عند تأكسده عدد مختلف من المركبات ويتوقف ذلك على ظروف التفاعل وذلك لاحتوائه على مجموعتين هيدروكسيل أولية ومجموعة ثانوية.
– عندما يتم التأكسد باستخدام عوامل يؤكسدة ضعيفة مثل هيدروبرميد الصوديوم أو فوق أكسيد الهيدروجين يعطى خليط من الجليسرالدهيد. وثنائي هيدروكسيد أستيون.
– أما إذا تم التأكسد بواسطة حمض النيتريك المخفف كعامل مؤكسد قوي يعطى حامض الجليسريك كما يلي:
إستخدامات الجليسرول
– يدخل الجليسرول في استخدامات صناعية واسعة حيث يستخدم صيدلانياً في تحضير مراهم ومعاجين الأسنان ومواد التجميل.
– كما يدخل في صناعة الأقمشة والتبوغ (مرطب ومانع للجفاف).
– تحتوي زيوت الضغط العالي ( الهايدروليك) على نسبة من الجليسرول الذي يستخدم كمانع للتجمد في مبردات السيارات ومقاييس الغاز بالإضافة إلى ذلك استخدامه في أشرطة آلات الطابعة وأحبار الطبع.
– كما أن الطلب الكبير والواسع للجليسرول هو في صناعة المتفجرات لتحضير النتروجليسرين والديناميت.
– كذلك فأن الجليسرول يستخدم كمادة أولية في صناعة راتنجات الألكايد ( الألكايد والكلبتال Alkyds, glyptals).
المراجع
- الكيمياء العضوية الإليفاتية – د/ عادل شاكر الطائي – دار المسيرة للنشر والتوزيع – عمان – الأردن – 2009
- Organic chemistry / L.G. Wade, Jr / 8th ed, 2013 / Pearson Education, Inc. USA
- Unergraduate Organic Chemistry /Dr. Jagdamba Singh, Dr. L.D.S Yadav / 1st ed, 2010/ Pragati prakashan Educational Publishers, India.
- Organic chemistry / William H. Brown , Christopher S. Foote , Brent L. Iverson , Eric V. Anslyn , Bruce M. Novak . ( sixth edition ) . United States