أسئلة وإجاباتالكيمياءالكيمياء الفيزيائية
مسائل محلولة على العلاقة بين الإنثالبي والأنتروبي والطاقة الحرة
فى هذا الموضوع سوف نستعرض (8) مسائل بأفكار مختلفة على العلاقة بين الإنثالبي والأنتروبي والطاقة الحرة حيث قمنا بعرض الإجابات بطريقة سهلة وبسيطة.
مثال(1):
لدیك التفاعل التالي:
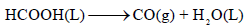
فإذا كانت قيمة (ΔH) للتفاعل تساوي (15.79 kJ) ، والتغير في الأنتروبي (ΔS) تساوي (232.63 J/K) احسب قيمة التغير في الطاقة الحرة (ΔG) عند (25 Co) وهل التفاعل تلقائي؟
الحل:
یمكن حل ھذه المسألة بالعلاقة:

وبما أن قیمة التغیر في الطاقة الحرة بالسالب فالتفاعل تلقائي عند(25 Co).
مثال (2):
لدیك التفاعل التالي:
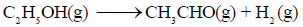
فإذا كانت قيمة التغير في الأنثالبي(ΔHo) للتفاعل تساوي (68.95 kJ) ، وقيمة التغير في الأنتروبي (ΔSo) تساوي (114.2 J/K) احسب قيمة التغير في الطاقة الحرة (ΔGo) عند (25 Co) وهل التفاعل تلقائي؟
الحل:
بتطبیق العلاقة:
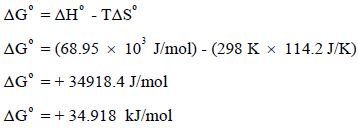
ومن ھنا فإن التفاعل غیر تلقائي عند درجة حرارة (25 Co) لأن إشارة قیمة التغیر في الطاقة الحرة بالموجب (ΔGo = +)
مثال (3):
لدیك التفاعل التالي:
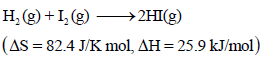
احسب:
(أ) ΔGo عند درجة حرارة (25 Co) وضغط جوي واحد
(ب) ΔGo عند درجة حرارة (200 Co) وضغط جوي واحد
الحل:
(أ) بتطبیق العلاقة:
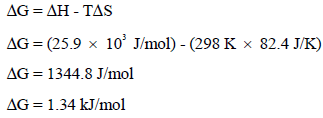
وبما أن قیمة التغیر في الطاقة الحرة بالموجب (ΔG = +) فالتفاعل السابق غیر تلقائي عند درجة حرارة (25 Co)
(ب) حساب التغیر في الطاقة الحرة عند درجة حرارة (200 Co)
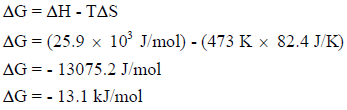
وبما أن قیمة التغیر في الطاقة الحرة بالسالب (ΔGo = – ) فالتفاعل السابق یكون تلقائیاً عند درجة حرارة (200 Co)
مثال (4):
احسب التغیر في كل من الإنثالبي والأنتروبي والطاقة الحرة عند الظروف القیاسیة المصاحبة للتفاعلین:
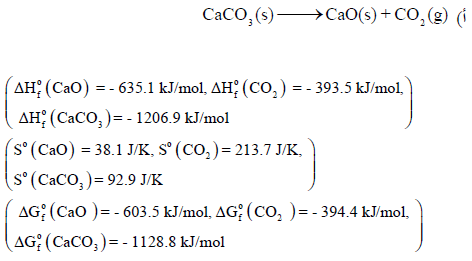
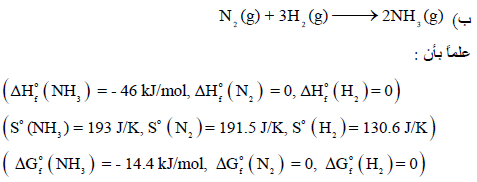
الحل:
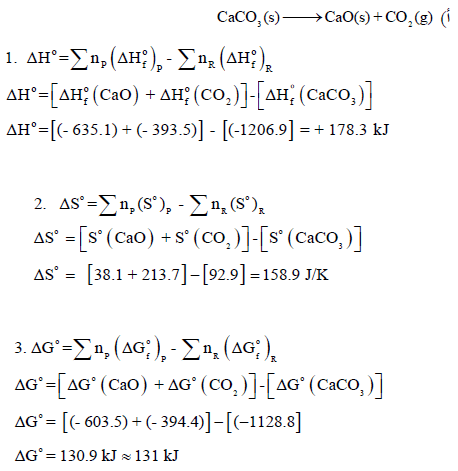
ویمكن حساب التغیر في الطاقة الحرة ΔGo باستخدام العلاقة:
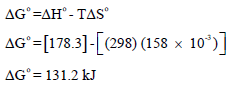
وھي نفس القیمة المحسوبة بالقانون:
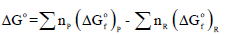
وتدل قیمتھا الموجبة على أن التفاعل لیس لدیه القابلیة لأن یحدث تلقائیاً عند الظروف القیاسیة (25 Co , 1atm)
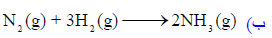
بنفس إجراء الخطوات السابقة نحصل على القیم التالیة:
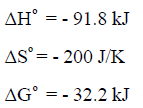
وتدل القیمة السالبة للتغیر في الطاقة الحرة القیاسیة (ΔGo = -32.2 kJ) أن التفاعل لديه القابلية أن يحدث عند درجة حرارة الغرفة.
مثال (5):
احسب طاقة التكوین الحرة القیاسیة (ΔGo) لمول من غاز النشادر إذا علمت أن:
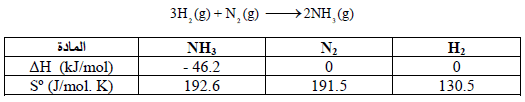
الحل:
أولاً: نحسب التغیر في الأنتروبي القیاسي كما یلي:

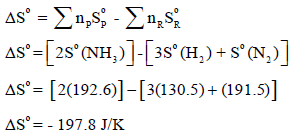
ثانیاً: نحسب التغیر في الإنثالبي كما یلي:

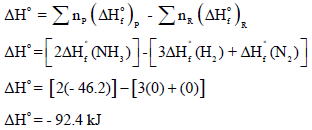
ثالثاً: لحساب التغیر في الطاقة الحرة القیاسیة:

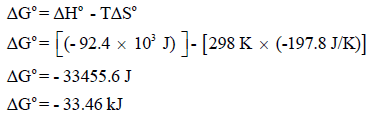
وهذة القيمة (ΔGo = -33.46 kJ) تعبر عن طاقة التكوین الحرة لمولین من النشادر كما في المعادلة السابقة، ولذلك للحصول على طاقة التكوین الحرة القیاسیة لمول من غاز النشادر نقسم ھذه القیمة على (2):

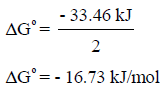
مثال (6):
لدیك التفاعل التالي:

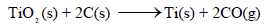
ھل یحدث ھذا التفاعل تلقائیاً عند درجة حرارة (298K) علماً بأن:

الحل:
أولاً: نحسب التغیر في الإنثالبي القیاسي (ΔHo)

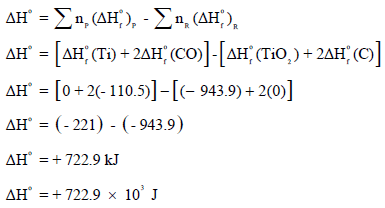
ثانياً: نحسب التغیر في الأنتروبي القیاسي (ΔSo)

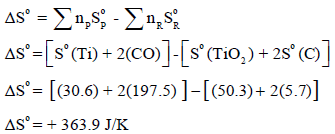
ثالثاً: نحسب التغیر في الطاقة الحرة القياسية (ΔGo)

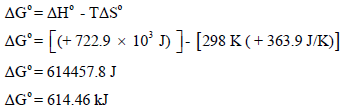
وحیث أن قیمة الطاقة الحرة بالموجب، لذلك فالتفاعل السابق غیر تلقائي عند درجة حرارة 298 K
مثال (7):
حسب التفاعل التالي:

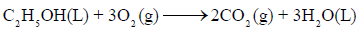
بالاستعانة بالمعلومات التالیة عند درجة حرارة (25 Co)

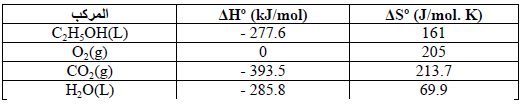
احسب:
(أ) (ΔHo)
(ب) (ΔSo)
(جـ) (ΔGo)
(د) ΔG عند درجة حرارة (100 Co) بافتراض أن (ΔHo = ΔH , ΔSo = ΔS)
الحل:
(أ) حساب التغیر في الإنثالبي القیاسي (ΔHo):

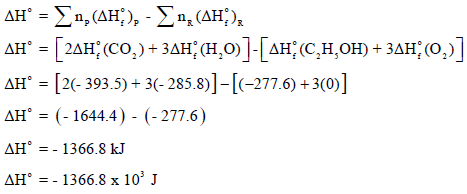
(ب) حساب التغیر في الأنتروبي القیاسي (ΔSo):

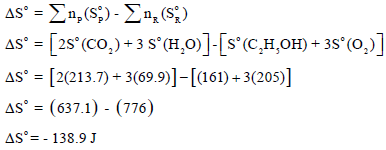
(جـ) حساب التغیر في الطاقة الحرة القياسية (ΔGo):

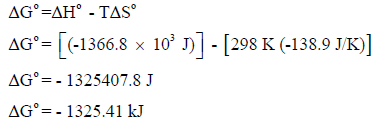
وبما أن قیمة التغیر في الطاقة الحرة بالسالب (ΔGo = -) فالتفاعل تلقائي عند درجة حرارة (25 Co)
(د) حساب ΔG عند درجة حرارة :(100 Co)
في ھذه الحالة تم افتراض أن (ΔHo = ΔH , ΔSo = ΔS)
بالتالي فإن التغیر في الطاقة الحرة یحسب من العلاقة:
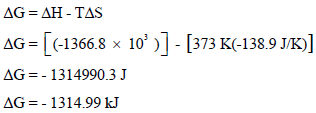
وبما أن قیمة الطاقة الحرة بالسالب فالتفاعل تلقائي عند درجة الحرارة (100 Co)
مثال (8):
(أ) احسب ΔGo التفاعل التالي:
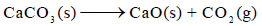
باستخدام المعلومات التالية:

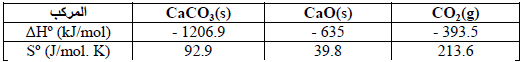
(ب) وإذا كان التفاعل غیر تلقائي، فما درجة الحرارة التي یكون عندھا التفاعل تلقائیاً؟
الحل:
(أ) أولاً: حساب التغیر في الإنثالبي القیاسي (ΔHo):
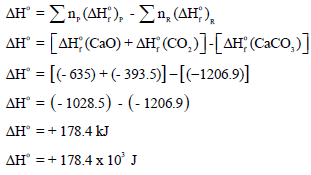
ثانياً: حساب التغیر في الأنتروبي القیاسي (ΔSo):

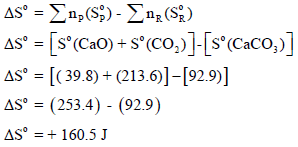
ثالثاً: حساب التغیر في الطاقة الحرة القياسية (ΔGo):

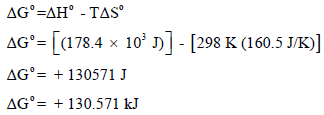
(ب) ولمعرفة درجة الحرارة التي یكون فیھا التفاعل تلقائیاً:
نحدد درجة الحرارة التي یكون (ΔG = 0)(وبفرض ان قيم (ΔHo = ΔH , ΔSo = ΔS) أى لا تتغير درجة الحرارة
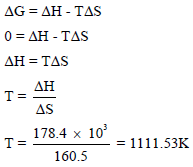
وبالتالي فإنه عند الدرجة (111.53 K) تكون (ΔG = 0) ويكون التفاعل متزناً، وتكون الدرجة من الحرارة التى يكون فيها التفاعل:

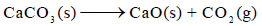
تلقائیاً ھي (T > 1111.53 K) أي درجة حرارة أعلى من (1111.53 K)
المراجع
– مسائل محلولة على العلاقة بين الإنثالبي والأنتروبي والطاقة الحرة – أسس الكيمياء العامة والفيزيائية – الجزء الأول.عمر بن عبد الله الهزازي ، قسم الكيمياء- كلية العلوم – جامعة أم القرى – المملكة العربية السعودية
المراجع
– مسائل محلولة على العلاقة بين الإنثالبي والأنتروبي والطاقة الحرة – أسس الكيمياء العامة والفيزيائية – الجزء الأول.عمر بن عبد الله الهزازي ، قسم الكيمياء- كلية العلوم – جامعة أم القرى – المملكة العربية السعودية