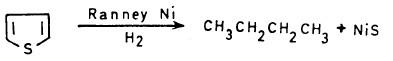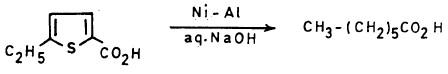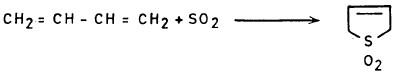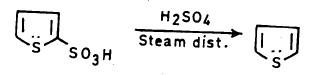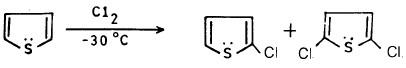تفاعلات الثيوفين Thiophene reactions (الخواص الكيميائية للثيوفين)
في الموضوعات السابقة تم مناقشة مركب الثيوفين Thiophene (طرق تحضير الثيوفين ومشتقاته – الخواص الفيزيائية). وفي هذا الموضوع سيتم مناقشة جميع التفاعلات الكيميائية للثيوفين.
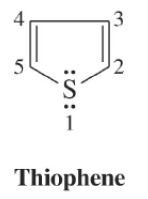
ما هو الثيوفين Thiophene؟
– هو مركب أروماتي خماسي الحلقة غير متجانس يحتوي على ذرة كبريت واحدة.
– يحدد مكان السلسة الجانبية أو المجاميع الفعالة على الحلقة بأعداد. ويجب أن تأخذ ذرة الكبريت رقم (1).
– يوجـد في قطران الفحم إلا أنه لا يوجد بشكل حر في الطبيعة.
– البنزين الناتج من تقطير قطران الفحم يحتوي على 0.5٪ من الثيوفين وذلك لتقارب درجة غليانها فالبنزين يغلي عند 80مo بينما الثيوفين يغلي عند 84مo كما أن درجة غليان مشتقاتها متقاربة.
تفاعلات الثيوفين Thiophene reactions
الخواص الكيميائية للثيوفين
– الثيوفين مركب أروماتي ذا طاقة تأرجحية عالية تقترب من تلك التي للبنزين. وهذا يعني أنه مركب ثابت يشبه البنزين في كثير من تفاعلاته إلا أنه أكثر نشاطاً وأقل استقراراً من البنزين.
– أما خواص الثيوفين التي تعزى إلى وجوده على شكل Diene-1,3 فإنها قليلة وإن كانت موجودة.
– الثيوفين ثابت تجاه جميع الحموض إلا تلك المركزة والقوية جداً. ولذلك فإن كثيراً من التفاعلات التي تؤدي إلى تكسر أو بلمرة البيرول أو الفيوران يستطيع الثيوفين القيام بها.
– وعلى العموم فإن الثيوفين يمكن أن يقوم بالتفاعلات الآتية:
أولاً/ تفاعلات الإضافة Addition reactions
– يستطيع الثيوفين القيام بعدد من تفاعلات الإضافة منها:
(1) التفاعل مع الأحماض Reaction of Thiophene with acids
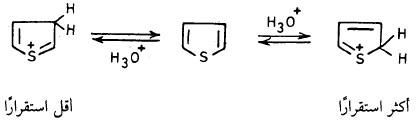
يستطيع الثيوفين أن يضيف بروتون الحمض في وسط مائي من حمض الكبريتيك إلى موضع (2) بصورة أسرع من الإضافة إلى البنزين بمقدار 1000 مرة وإلى موضع (3) بصورة تشبه إضافته إلى البنزين. وناتج الإضافة إلى موضع (2) أكثر استقراراً منه في موضع (3).
(2) اختـزال الثيوفين Reduction of Thiophene
– الثيوفين لا يختزل بواسطة خليط من المعدن والحمض ولا بواسطة هيدريدات المعادن.
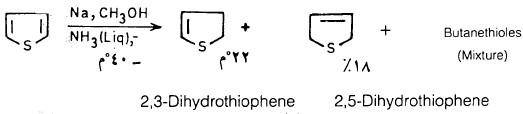
– إلا أنه يمكن اختزال الثيوفين جزئياً بواسطة الصوديوم في خليط من الميثانول والأمونيا عند درجة حرارة منخفضة – 40°م. ويتكون نتيجة هذا التفاعل مزيج من 3٫2- ثنائي هيدروثيوفين بصورة رئيسية. وهذا مركب ذو فعالية عالية، و5,2ـ ثنائي هيدروثيوفين وهذا مركب ثابت وبنسبة أقل.
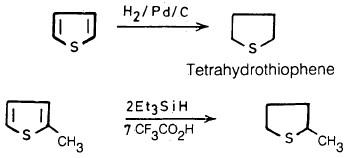
– يمكن اختزال الثيوفين كلياً إلى التتراهيدروثيوفين عن طريق الهدرجة في وجود البلاديوم كعامل مساعد.
– كذلك يمكن استخدام هيدريد ثلاثي إيثيل السلنيوم في الوسط الحمضي للحصول على تتراهيدروثيوفين.
– أما اختزال الثيوفين بواسطة الهيدروجين والنيكل كعامل مساعد فإنه يؤدي إلى إخراج الكبريت على شكل كبريتيد النيكل وفتح الحلقة.
– وتستعمل هذه الطريقة في تحضير المركبات الأليفاتية ومشتقاتها.
-على سبيل المثال يحضر حمض الهبتانويك من معاملة 5- إيثيل ثيوفين –2- حمض الكربوكسيل بواسطة Ni-Al في وجود قاعدة.
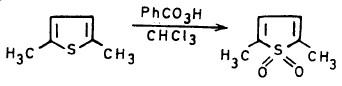
(3) أكسدة الثيوفين Oxidation of Thiophene
– الأكسدة المباشرة للثيوفين تؤدي أولاً إلى 1- أوكسيد (Oxide-1) ثم إلى 1,1- ثنائي أكسيد والذي يتبلمر في وسط التفاعل.
– وقد أمكن الحصول على 1ـ أوكسيد بالطريقة التالية:
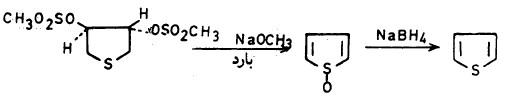
وجميع المحاولات لعزله تؤدي إلى الحصول على دايمر dimer وقد تم التحقق من تركيبه عن طريق اختزاله إلى الثيوفين كما في المعادلة السابقة.
– أمـا مركب 1٫1- ثنائي الأكسيد فقـد أمكن تحضيره بطريقـة تحلق مركب البيوتادايين مع ثاني أكسيد الكبريت.
– وقد دلت التجارب على أن أوكسيد الثيوفين لا يملك كثيراً من الصفة العطرية ولكنه يتصرف وكأنه 1,3Diene مع حمض الماليك اللامائي.
(4) بلمرة الثيوفين Polymerization of Thiophene
– الثيوفين ثابت في الحمـوض المخففـة.
– أما في الحموض المعدنية المركزة مثل حمض الفسفوريك فإن حلقة الثيوفين تنفتح.
– بينما في حمض الكبرتيك وحموض لويس القوية فإنها تؤدي إلى بلمرة الثيوفين ولهذا السبب فإن ثالث كلوريد الألمنيوم لا يساعد على تفاعلات فريدل ـ كرافتز مع الثيوفين.
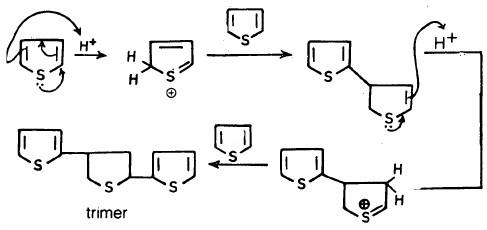
– وتحت ظروف هادئة نجد أن الثيوفين يتبلمر في الوسط الحمضي ليعطي جزيئاً ثلاثياً ( Trimer) كما في المعادلة التالية:
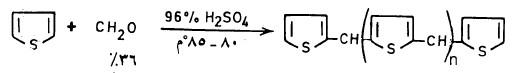
أما في وجود الفورمالدهيد وحمض الكبرتيك المركز فإن عملية البلمرة إلى الراتنج (Resin) تتم وفق المعادلة التالية:
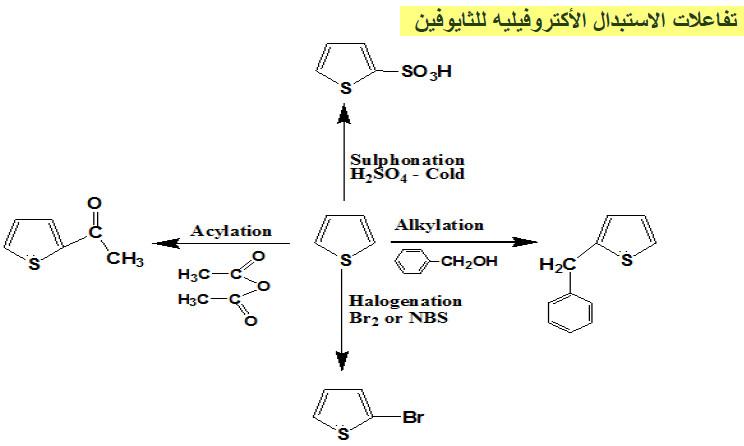
ثانياً/ تفاعلات الاستبدال الإلكتروفيلية للثيوفين Electrophilic substitution reactions
– كما هو الحال في الفيوران يمكن أن نتوقع أن تفاعلات الاستبدال الإلكتروفيلية تعتمد على توزيع الشحنة وثباتية أيون الكربونيوم. وهذه تفضل مواضع 2 أو 5 على مواضع 3 أو 4 وهذا ما وجد فعلاً في التجربة.
– والثيوفين كما ذكرنا سابقاً مركب ثابت تجاه الحموض ولذلك فإن كثيراً من تفاعلات الاستبدال الإلكتروفيلية يمكن أن تتم مع الثيوفين تحت ظروف أقرب ما تكون إلى تلك الظروف المستخدمة عند التفاعل مع البنزين إلا أنها أهدأ.
– ومن أهم هذه التفاعلات:
(1) نيترة الثيوفين Nitration of Thiophene
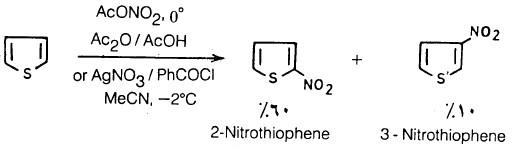
– يمكن نيترة الثيوفين تحت ظروف أقل قساوة من تلك مع البنزين مثل استخدام حمض النيتريك المدخن في حمض الخل اللامائي عند درجة حرارة منخفضة حيث تعطي حصيلة مرتفعة من 2- نيتروثيوفين ونسبة قليلة من 3- نيتروثيوفين.
أما نيترة الثيوفين تحت ظروف مشابهة لتلك المستخدمة مع البنزين فإنها تؤدي إلى حدوث تفاعل شديد جدا يؤدي إلى فتح الحلقة.
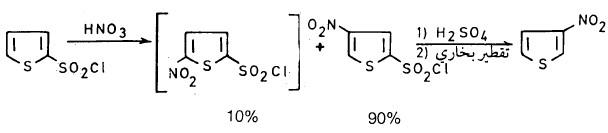
وعلى أية حال فإن 3- نيتروثيوفين يمكن أن يحضر بحصيلة مرتفعة بطريقة غير مباشرة وذلك بنيترة مركب 2- ثيوفين سلفونايل كلورايد ثم معاملة الناتج بحمض الكبريتيك يلي ذلك فصله بالتقطير البخاري.
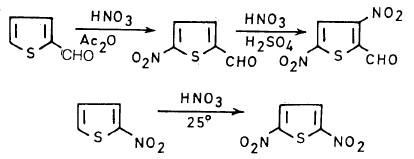
وهذا يدل على أنه عندما توجد مجاميع ساحبة للإلكترونات على حلقة الثيوفين فإن عملية النيترة تصبح أسهل إلى درجة أنه يمكن استخدام خليط من حمض النيتريك والكبريتيك في عملية النيترة، كما يتبين ذلك من المعادلات الآتية:
(2) سلفنـة الثيوفين Sulphonation of Thiophene
– يتفاعل الثيوفين مع حمض الكبريتيك المركز عند درجة حرارة 30°م وهذا التفاعل يعطي خليطاً من حمض ثيوفين -2- سلفونيك بصورة رئيسية وحمض ثيوفين -3- سلفونيك بكمية أقل، كما تبين ذلك المعادلة التالية:
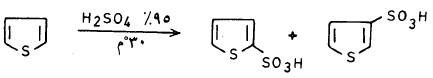
– ومن الجدير بالذكر أن سلفنة الثيوفين تتيح إمكانية فصله عن البنزين وذلك لأنه على النقيض من البنزين يمكن سلفنته عند درجة حرارة الغرفة. ويتم ذلك لأن حمض ثيوفين –2 – سلفونيك يذوب في حمض الكبريتيك وعليه يمكن تنقية البنزين من الثيوفين بهذه الطريقة ثم يغسل بالماء جيداً ويجفف ويقطر.
– ومن جهة أخرى فإن مجموعة السلفونيك يمكن نزعها بواسطة التقطير البخاري وهذا يجعل هذه المركبات ذات قيمة تحضيرية كبيرة.
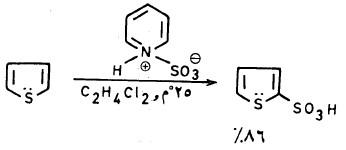
وقد أمكن الحصول على ناتج سلفنة أفضل يصل إلى 86% عند استخدام معقد البيريدين مع ثالث أكسيد الكبريت وقد تم عزل الناتج على شكل ملح الباريم . وذلك نتيجة لتفاعل حمض ثيوفين –2– سلفونيك مع 2(Ba(OH
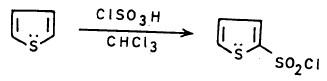
أما إدخال مجموعة SO2Cl- إلى حلقة الثيوفين فإنها تتم بسهولة إلا أن الناتج يكون منخفضاً.
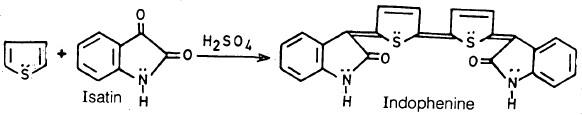
(3) الكشف عن الثيوفين Detection of Thiophene
– من أهم التفاعلات المميزة للثيوفين تفاعله مع الإيزاتين (Isatin) في وجود حمض الكبريتيك ليعطي مركباً ذا لون أزرق غامقاً هو مركب الإنـدوفينين ( Indophenine)
– هذا التفاعل يستعمل للكشف عن وجود الثيوفين في نواتج تقطير الفحم.
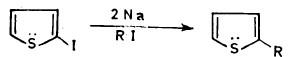
(4) الألكلة والأريلة Alkylation and arylation
– يمكن ألكلة الثيوفين بصورة مباشرة فهو يتفاعل مع الأوليفينات في وجود عوامل مساعدة مثل حمض الفسفوريك وثلاثي فلوريد البورون وحمض الكبرتيك المركز.
– وعلى أية حال فإن الإيزوبيوتيلين ( Isobutylene) يتفاعل بكل سهولة، أما البروبيلين فهو أبطأ منه وفي حالة الإيثلين فإنه لا يتفاعل.
– ومن الملاحظ أنه في الألكلة يتم الهجوم على موضعي 2 و 3 بالدرجة نفسها.
– ومن جهة أخـرى يتفاعل الثيوفين مع الكحول البنزيلي (Benzyl alcohol) في وجود كلوريد الزنك كما يلي:
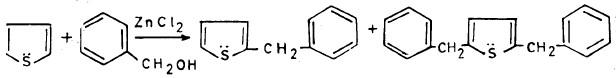
– أما عندما يتفاعل مع البنزالدهيد فإننا نحصل على:
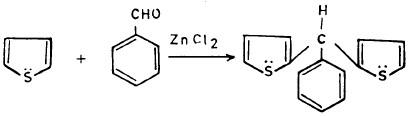
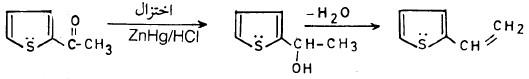
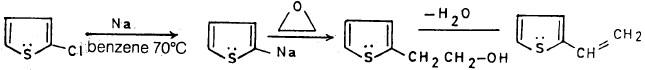
ومن جهة أخرى فإن هناك بعضاً من مشتقات الثيوفين الألكيلية تحضر بطرق غير مباشرة مثل 2 – فينايل ثيوفين (2Vinyl thiophene) يحضر بالطريقة التالية:
ويمكن تحضير هذا المركب بطريقة أخري:
– كما يمكن أن تتم الألكلة بطريقة فورتز – فتج (Wirtz-Fittig reaction).
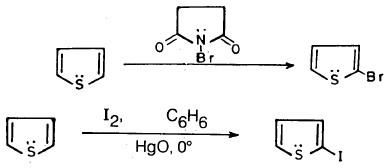
(5) هلجنـة الثيوفين Halogenation of Thiophene
– كلورة الثيوفين عند درجة حرارة عالية 50oم تعطي ناتجي استبدال وإضافة على أن نواتج الاستبدال وهما 2- كلوروثيوفين و2 , 5 ثنائي كلوروثيوفين هما الناتج الرئيسي.
– وللحصول على نواتج الاستبدال فقط تتم كلورة الثيوفين عند درجة حرارة منخفضة – 30مo.
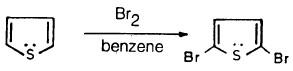
– أما عند برومة الثيوفين في البنزين فإن 5.2ـ ثنائي بروموثيوفين يكون هو الناتج الرئيسي وفي حالة استخدام حمض الخل نحصل على 2- بروموثيوفين كناتج رئيسي .
– أمـا مـركـب 2- برومـوثيوفين فيمكن الحصـول عليه باستخـدام (NBS) N-bromosuccinimide
– أما 2- أيودوثيوفين فيحضر من تفاعل الثيوفين مع اليود في وجود أكسيد الزئبق الأصفر.
– وحيث إن الهالوجينات عبارة عن ذرات ساحبة للإلكترونات فإنها تثبط من نشاط الثيوفين وعليه يكون أقل نشاطا وأكثر استقراراً.
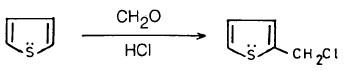
– ومن ناحية أخرى يمكن إدخال مجموعة الكيلية تحمل ذرة هالوجين بطريقة Chloromethylation وذلك بتفاعل الثيوفين مع الفورمالدهيد في وجود حمض كلوريد الهيدروجين (HCI)
(6) الأسيلـة Acylation of Thiophene
– تتم أسيلة الثيوفين بكل سهولة في موضع (2) وذلك بمعاملته بكلوريد الحمض في وجود كلوريد الخارصين.
– إلا أن تفاعله مع الحموض اللامائية في وجود حمض الفسفوريك يعطي ناتجاً أفضل.
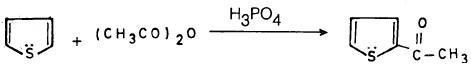
وهنـا يفضل استخدام كلوريد الخارصين أو حمض الفسفوريك على ثالث كلوريد الألمنيوم وذلك لأنهما أقل منه مساعدة على عملية البلمرة.
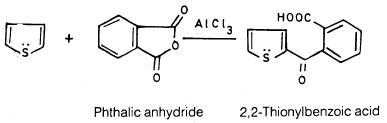
– وتتم عملية الأسيلة عنـد موضعي 2- أو 5-عندما يكونان غير مشغولين ومن ناحية أخرى يمكن أن يتفاعل حمض الفيثاليك اللامائي مع الثيوفين في وجود عامل مساعد مثل كلوريد الألومنيوم كالتالي:
ملخص تفاعلات الثيوفين
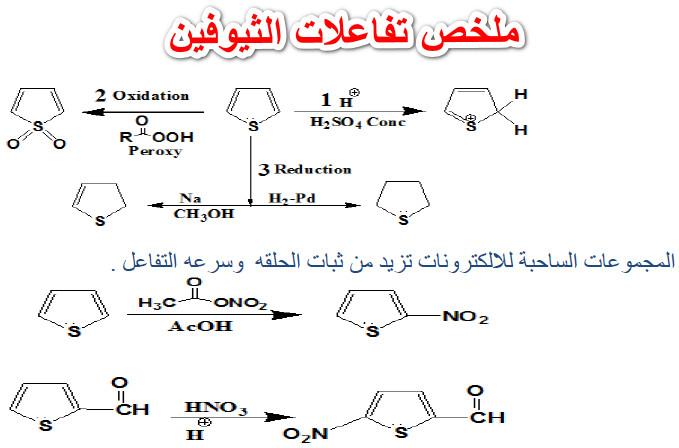
المراجع:
- كتاب المركبات الحلقية غير المتجانسة والحيوية للدكتور حمد بن عبدالله اللحيدان والدكتور محمد بن إبراهيم الحسن والدكتور سالم سليم الذياب – الطبعة الثانية – جامعة الملك سعود – المملكة العربية السعودية
- محاضرات 341 كيم كيمياء المركبات الحلقية غير المتجانسة Chemistry of Heterocyclic Compounds للدكتور عبدالله بن محمد الماجد – جامعة الملك سعود – السعودية
- كتاب الكيمياء العضوية للمؤلف د. حسن محمد الحازمي / الجزء الثاني